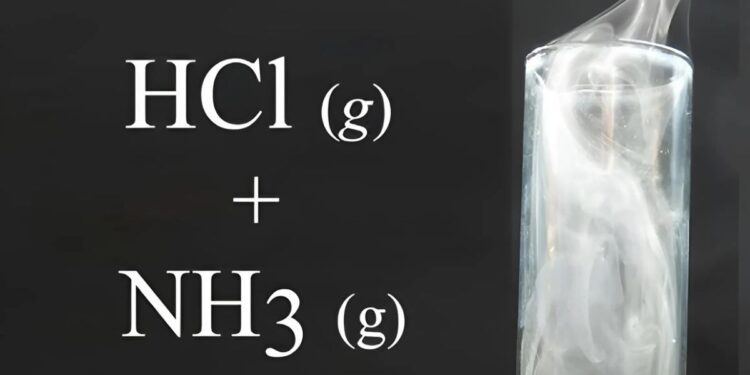Phản ứng giữa amoniac (NH3) và axit hydrochloric (HCl) là một trong những phản ứng hóa học cơ bản và quan trọng trong ngành hóa học. Sự tương tác giữa hai chất này không chỉ tạo ra muối amoni clorua (NH4Cl), mà còn mở ra nhiều ứng dụng thiết thực trong công nghiệp và phòng thí nghiệm. Bài viết này Hóa Học Phổ Thông sẽ giúp bạn hiểu rõ hơn về cơ chế phản ứng NH3 + HCl, tính chất của sản phẩm tạo ra, cũng như những ứng dụng thú vị của phản ứng này trong thực tiễn.
TÓM TẮT
Phản ứng giữa NH3 + HCl
Phản ứng giữa amoniac (NH3) và axit hydrochloric (HCl) là một ví dụ điển hình về phản ứng axit-bazơ, trong đó tính chất hóa học của nh3 hoạt động như một bazơ, còn HCl là axit mạnh. Phản ứng này diễn ra theo nhiều cơ chế và dẫn đến sự hình thành muối amoni clorua (NH4Cl). Dưới đây là các khía cạnh chi tiết của phản ứng này.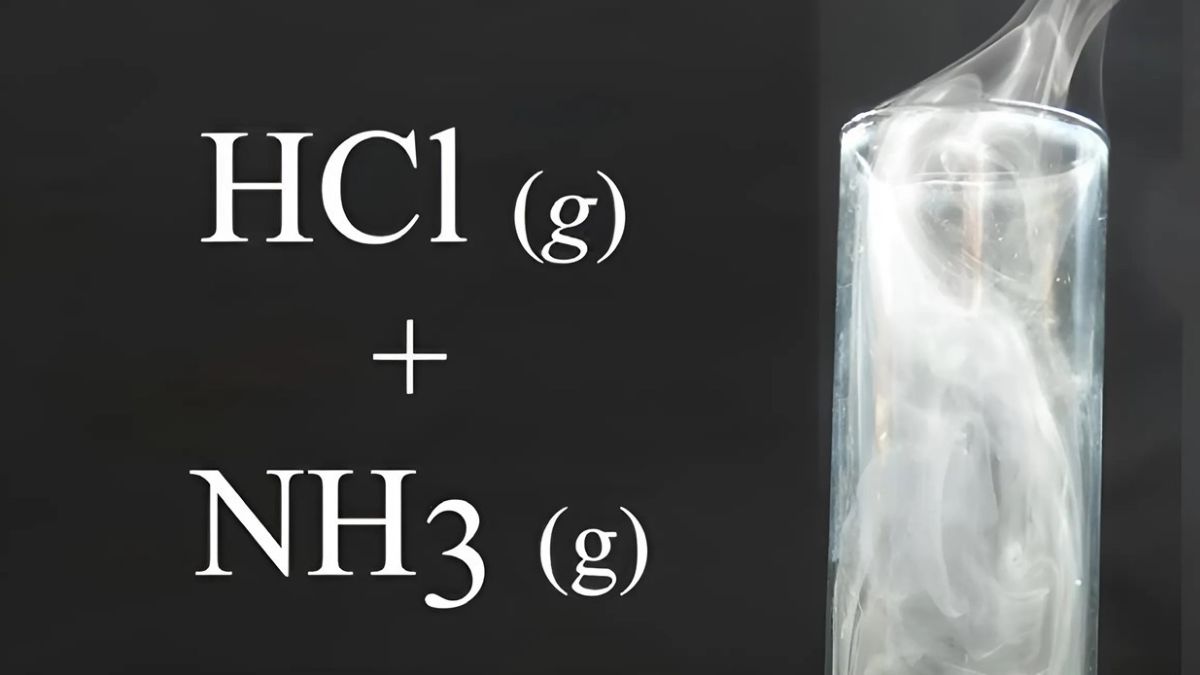
Cơ chế phản ứng giữa NH3 và HCl
Phản ứng giữa NH3 và HCl có thể được mô tả bằng cơ chế axit-bazơ Bronsted. Trong quá trình này, NH3 nhận proton (H⁺) từ HCl, trong khi HCl trở thành ion clorua (Cl⁻). Phản ứng này thể hiện khả năng của NH3 trong việc hoạt động như một bazơ khi tiếp nhận proton, trong khi HCl cung cấp proton như một axit.
Bước 1: NH3 + H⁺ → NH4⁺ (Ion amoni)
Bước 2: NH4⁺ + Cl⁻ → NH4Cl (Muối amoni clorua)
Cơ chế này cho thấy sự chuyển đổi của NH3 thành ion amoni (NH4⁺), cùng với sự tạo thành ion clorua từ HCl. Phản ứng giữa NH3 và HCl có thể được biểu diễn bằng phương trình hóa học sau:
NH₃ (g) + HCl (g) → NH₄Cl (s)
Phương trình này cho thấy rằng khi khí amoniac và khí axit hydrochloric tương tác, chúng tạo ra muối amoni clorua dưới dạng rắn.
Điều kiện xảy ra phản ứng NH3 + HCl
Phản ứng giữa NH3 và HCl có thể xảy ra trong điều kiện bình thường, nhưng thường được thực hiện trong môi trường ẩm hoặc dưới áp suất nhất định để tăng hiệu suất tạo ra muối. Một số điều kiện cụ thể bao gồm:
Nhiệt độ: Phản ứng này thường xảy ra ở nhiệt độ phòng, nhưng nhiệt độ cao hơn có thể làm tăng tốc độ phản ứng.
Áp suất: Áp suất có thể được điều chỉnh để kiểm soát tốc độ phản ứng, đặc biệt khi làm việc với các khí.
Môi trường: Môi trường ẩm có thể giúp giữ ẩm cho sản phẩm tạo ra và tăng hiệu suất phản ứng.
Phản ứng NH3 + HCl là một ví dụ minh họa rõ ràng về sự tương tác giữa axit và bazơ, đồng thời có ý nghĩa quan trọng trong các lĩnh vực hóa học và công nghiệp.
Khám phá ngay chuyên mục “Tài liệu hóa học phổ thông” để nắm vững kiến thức từ cơ bản đến nâng cao!
Ứng dụng của phản ứng NH3 + HCl
Phản ứng giữa amoniac (NH3) và axit hydrochloric (HCl) không chỉ quan trọng về mặt lý thuyết mà còn có nhiều ứng dụng thực tiễn trong các lĩnh vực khác nhau, từ công nghiệp hóa chất đến nghiên cứu trong phòng thí nghiệm. Dưới đây là những ứng dụng nổi bật của phản ứng này.
Ứng dụng của phản ứng trong công nghiệp hóa chất
Sản xuất muối amoni clorua (NH4Cl): Muối amoni clorua là sản phẩm chính của phản ứng giữa NH3 và HCl. Nó được sử dụng rộng rãi trong nhiều ứng dụng công nghiệp như sản xuất thuốc trừ sâu, phân bón và trong quá trình sản xuất thực phẩm. NH4Cl cũng được sử dụng trong ngành công nghiệp gốm sứ như một chất phụ gia.
Chất điều chỉnh pH: NH4Cl được sử dụng như một chất điều chỉnh pH trong các quy trình sản xuất hóa chất, giúp duy trì môi trường phản ứng tối ưu cho các phản ứng hóa học khác.
Chất đông lạnh: NH4Cl được sử dụng trong sản xuất dung dịch muối để làm chất đông lạnh trong các hệ thống làm lạnh công nghiệp, đặc biệt trong các ứng dụng cần nhiệt độ thấp.
Ứng dụng của phản ứng trong phòng thí nghiệm
Phản ứng giữa NH3 + HCl là một ví dụ điển hình được sử dụng trong giảng dạy và nghiên cứu hóa học. Nó giúp sinh viên và nhà nghiên cứu hiểu rõ hơn về các khái niệm như phản ứng axit-bazơ, cân bằng hóa học, và cơ chế phản ứng.
Muối amoni clorua tạo ra từ phản ứng này có thể được sử dụng trong các phương pháp phân tích hóa học để xác định sự hiện diện của amoniac trong các mẫu khác nhau.
Phản ứng giữa NH3 + HCl không chỉ có ý nghĩa lý thuyết mà còn đóng vai trò quan trọng trong nhiều lĩnh vực khác nhau. Từ sản xuất muối amoni clorua cho đến ứng dụng trong công nghiệp hóa chất và nông nghiệp, phản ứng này góp phần vào sự phát triển của nhiều ngành công nghiệp và phục vụ nhu cầu thiết yếu trong cuộc sống hàng ngày. Nắm vững ứng dụng của phản ứng này giúp các chuyên gia và sinh viên hóa học hiểu rõ hơn về tầm quan trọng của các phản ứng hóa học trong thực tiễn.
Kết luận
Như vậy, phản ứng giữa NH3 + HCl không chỉ là một hiện tượng hóa học đơn giản mà còn mang lại giá trị lớn trong nhiều lĩnh vực khác nhau. Việc nắm vững cơ chế và ứng dụng của phản ứng này sẽ giúp các sinh viên, nhà khoa học, và kỹ sư hóa học có thêm kiến thức bổ ích trong nghiên cứu và thực tiễn. Hãy tiếp tục khám phá thế giới hóa học để phát hiện thêm nhiều điều kỳ diệu từ các phản ứng khác nhau!
Có thể bạn quan tâm: