NH₃, hay amoniac, là một hợp chất hóa học quan trọng với nhiều ứng dụng trong đời sống và công nghiệp. Ngoài những tính chất vật lý dễ nhận biết như mùi khai và khả năng hòa tan trong nước, NH₃ còn có tính chất hóa học đặc biệt, từ khả năng phản ứng với axit đến tạo phức với ion kim loại. Bài viết này sẽ giúp bạn khám phá chi tiết các tính chất hóa học của NH3 và hiểu rõ hơn về vai trò của nó trong thực tiễn.
TÓM TẮT
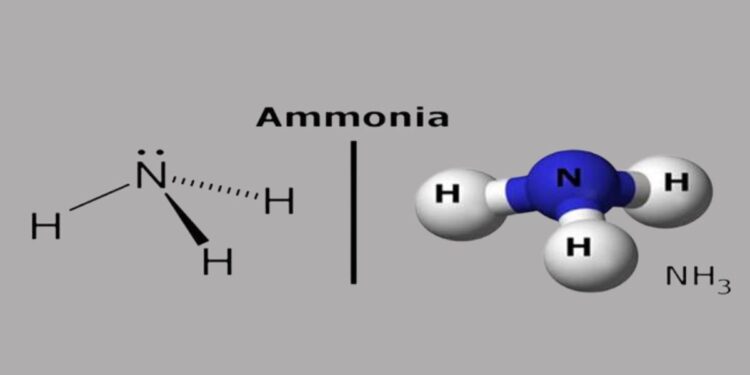
Cấu trúc phân tử của NH3
Phân tử NH₃ (amoniac) có công thức hóa học là NH₃, bao gồm 1 nguyên tử nitơ (N) liên kết với 3 nguyên tử hydro (H) bằng các liên kết cộng hóa trị.
Hình học phân tử: NH₃ có hình chóp tam giác với nguyên tử nitơ nằm ở đỉnh và ba nguyên tử hydro ở ba đỉnh của tam giác đáy.
Góc liên kết: Góc giữa các liên kết N-H khoảng 107°, nhỏ hơn góc chuẩn 109,5° của cấu trúc tứ diện do cặp electron tự do trên nguyên tử nitơ gây ra lực đẩy mạnh.
Liên kết cộng hóa trị phân cực: Liên kết giữa N và H là liên kết cộng hóa trị phân cực vì nitơ có độ âm điện cao hơn hydro. Điều này làm cho phân tử NH₃ có một đầu hơi âm (nitơ) và một đầu hơi dương (ba nguyên tử hydro).
Nguyên tử nitơ trong NH₃ có một cặp electron chưa liên kết (cặp đơn), tạo nên tính chất lưỡng cực của phân tử và làm cho NH₃ có khả năng hoạt động như một bazơ Lewis (có thể nhận proton H⁺). Do tính phân cực, NH₃ dễ dàng tan trong nước và có thể tạo liên kết hydro với các phân tử khác, ảnh hưởng đến tính chất vật lý và hóa học của nó.
Tính chất vật lý của NH₃
Amoniac (NH₃) là một hợp chất khí không màu với nhiều tính chất vật lý đặc trưng:
Trạng thái và Mùi: NH₃ tồn tại chủ yếu dưới dạng khí ở nhiệt độ và áp suất thường. Nó có mùi khai rất đặc trưng, dễ nhận biết và có thể gây khó chịu khi hít phải.
Nhiệt độ sôi và nhiệt độ nóng chảy: NH₃ có điểm sôi khoảng -33,34°C và điểm nóng chảy khoảng -77,7°C. Điều này cho thấy NH₃ dễ bay hơi và thường tồn tại dưới dạng khí trong điều kiện bình thường.
Khả năng hòa tan: NH₃ có khả năng hòa tan rất tốt trong nước, với tỷ lệ hòa tan đạt khoảng 700g NH₃ trong 1 lít nước ở nhiệt độ phòng. Khi hòa tan, nó tạo thành dung dịch amoniac (NH₄OH), một dung dịch có tính bazơ mạnh.
Khối lượng riêng: Khối lượng riêng của NH₃ là khoảng 0,73 kg/m³, nhẹ hơn không khí (khối lượng riêng không khí khoảng 1,29 kg/m³). Điều này làm cho NH₃ có xu hướng nổi lên trong không khí.
Tính dẫn điện: NH₃ và dung dịch amoniac không dẫn điện tốt trong trạng thái khí, nhưng khi hòa tan trong nước, dung dịch này có thể dẫn điện do sự hình thành các ion NH₄⁺ và OH⁻.
Khám phá ngay chuyên mục “Tài liệu hóa học phổ thông” để nắm vững kiến thức từ cơ bản đến nâng cao!
Tính chất hóa học của NH₃
NH₃ (amoniac) có nhiều tính chất hóa học quan trọng, thể hiện khả năng phản ứng đa dạng của nó với các chất khác. Dưới đây là một số tính chất hóa học nổi bật của NH₃:
Tính Bazơ của NH3
NH₃ là một bazơ mạnh, có khả năng nhận proton (H⁺) từ các axit. Khi phản ứng với axit, NH₃ tạo thành các muối amoni. Ví dụ:
NH₃ + HCl → NH₄Cl (muối amoni clorua)
NH₃ + H₂SO₄ → (NH₄)₂SO₄ (muối amoni sulfat)
Cùng chủ đề:
- Phản ứng NH3 + HCl: Cơ chế phản ứng và ứng dụng thực tiễn
- Phản ứng giữa NH3 + H2SO4: Ứng dụng và lợi ích
NH3 phản ứng với nước
Khi hòa tan trong nước, NH₃ phản ứng để tạo ra dung dịch amoniac, mà trong đó, một phần NH₃ phân ly thành ion amoni (NH₄⁺) và ion hydroxyl (OH⁻), làm cho dung dịch có tính kiềm:
NH₃ + H₂O ⇌ NH₄⁺ + OH⁻
Cùng chủ đề: Phản ứng NH3 + H2O: Cơ chế phản ứng và ứng dụng thực tiễn
Khả năng tạo liên kết hydro của NH3
NH₃ có khả năng tạo liên kết hydro với các phân tử nước và các chất khác, giúp tăng cường tính tan trong nước và tương tác với các phân tử khác.
Phản ứng oxi hóa
NH₃ có thể phản ứng với các chất oxi hóa mạnh như clo (Cl₂) và oxy (O₂) để tạo ra các sản phẩm khác. Ví dụ:
2NH₃ + 3Cl₂ → NCl₃ + 3HCl
Cùng chủ đề: NH3 + Cl2: Phản ứng hóa học và ứng dụng thực tiễn
Khả năng tạo phức chất
NH₃ có thể tạo phức với các ion kim loại, ví dụ:
NH₃ + Cu²⁺ → [Cu(NH₃)₄]²⁺
Cùng chủ đề: Phản ứng NH₃ + CuO: Cơ chế, ứng dụng và tầm quan trọng
Đây là phức đồng(II) amoniac, thường được sử dụng trong phân tích hóa học. Tóm lại, NH₃ không chỉ có tính chất bazơ mạnh mà còn tham gia vào nhiều phản ứng hóa học khác nhau, làm cho nó trở thành một hợp chất quan trọng trong cả hóa học lý thuyết và thực tiễn.
Ứng dụng của NH3 trong thực tiễn
NH₃ (amoniac) có nhiều ứng dụng quan trọng trong thực tiễn. Đầu tiên, nó là nguyên liệu chính để sản xuất các loại phân bón như ure và amoni nitrat, cung cấp nitrogen thiết yếu cho cây trồng.
Trong ngành hóa chất, NH₃ được sử dụng để sản xuất axit nitric và các hợp chất amoni khác. Ngoài ra, NH₃ còn được ứng dụng rộng rãi làm chất làm lạnh hiệu quả trong các hệ thống công nghiệp. Trong lĩnh vực tẩy rửa, nhiều sản phẩm chứa dung dịch amoniac nhờ khả năng hòa tan chất bẩn. Cuối cùng, NH₃ cũng được sử dụng trong y học, bao gồm các dung dịch tiêm và nghiên cứu sinh học. Nhìn chung, NH₃ là hợp chất thiết yếu, góp phần quan trọng vào nông nghiệp, công nghiệp và y học.

Kết luận
Như vậy, NH₃ không chỉ có các tính chất hóa học đa dạng mà còn đóng vai trò quan trọng trong nhiều lĩnh vực, từ sản xuất phân bón đến làm lạnh. Việc nắm vững những tính chất này không chỉ giúp ích cho việc học tập mà còn mở ra cơ hội ứng dụng rộng rãi trong đời sống và công nghiệp.