Sắt là một trong những nguyên tố hóa học cơ bản trong bảng tuần hoàn, được ký hiệu bằng chữ cái “Fe” và có số hiệu nguyên tử là 26. Là một trong những kim loại phong phú nhất trên Trái Đất, sắt đóng vai trò quan trọng trong cấu trúc của lớp vỏ Trái Đất và cũng là thành phần chính trong lõi Trái Đất. Hãy cùng hoahocphothong khám phá thật kỹ hơn về tính chất hóa học của sắt nhé!
Kí hiệu: Fe
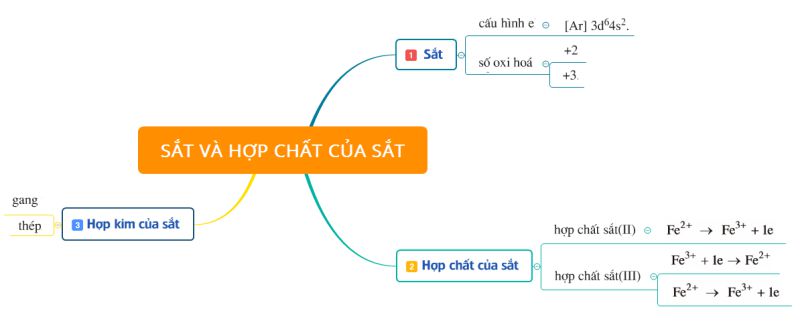
Cấu hình electron: 1s²2s²2p⁶3s²3p⁶3d⁶4s² hoặc [Ar] 3d⁶4s²
Số hiệu nguyên tử: 26
Khối lượng nguyên tử: 56 g/mol
Vị trí trong bảng tuần hoàn:
Ô: số 26
Nhóm: VIIIB
Chu kỳ: 4
Đồng vị: Sắt có nhiều đồng vị khác nhau như 55Fe, 56Fe, 58Fe, 59Fe.
Độ âm điện: 1,83
TÓM TẮT
Tính Chất Vật Lý và Nhận Biết
Tính Chất Vật Lý
Sắt là một kim loại có màu trắng hơi xám, mang lại cảm giác dẻo và dai. Nó rất dễ rèn và có nhiệt độ nóng chảy khá cao, đạt khoảng 1540°C. Một số đặc điểm vật lý đáng chú ý của sắt bao gồm:
Dẫn điện và dẫn nhiệt tốt: Điều này khiến sắt trở thành lựa chọn lý tưởng cho các ứng dụng trong điện và nhiệt.
Tính nhiễm từ: Sắt có khả năng bị nam châm hút, một trong những yếu tố quan trọng giúp nhận biết nó trong tự nhiên.
Để nhận biết sắt, bạn có thể sử dụng một nam châm. Nếu sắt có mặt, nó sẽ bị nam châm hút một cách dễ dàng.
Tính Chất Hóa Học
Tính chất hóa học của kim loại Sắt là tính khử trung bình, có khả năng bị oxi hóa lên mức +2 hoặc +3 tùy thuộc vào các chất oxi hóa mà nó gặp phải. Các phương trình phản ứng điển hình như sau:
Fe→Fe2++2e−Fe
Tác Dụng Với Phi Kim
Tác Dụng Với Lưu Huỳnh
Sắt có khả năng phản ứng với lưu huỳnh, tạo thành sắt (II) sulfit.
Tác Dụng Với Oxi
Sắt phản ứng với oxi để tạo thành oxit sắt, một quá trình quan trọng trong việc hình thành rỉ sét.
Tác Dụng Với Clo
Khi sắt gặp khí clo, nó sẽ phản ứng mạnh mẽ và tạo thành sắt (III) clorua.
Tác Dụng Với Axit
Sắt có khả năng phản ứng với nhiều loại axit khác nhau:
Tác Dụng Với Dung Dịch Axit HCl và H2SO4 Loãng
Khi tiếp xúc với dung dịch axit HCl hoặc H2SO4 loãng, sắt sẽ thải ra khí hydro.
Fe+2H+→Fe2++H2Fe + 2H^{+}
Tác Dụng Với Axit HNO3 và H2SO4 Đặc
Sắt phản ứng với axit nitric và axit sulfuric đặc để tạo ra muối sắt và khí oxit nitơ.
Fe+4HNO3→Fe(NO3)3+NO+2H2OFe + 4HNO_{3}
Lưu ý rằng trong điều kiện axit HNO3 đặc nguội hoặc H2SO4 đặc nguội, sắt sẽ bị thụ động hóa.
Tác Dụng Với Dung Dịch Muối
Sắt có khả năng đẩy kim loại đứng sau nó ra khỏi dung dịch muối của chúng.
Fe+CuSO4→FeSO4+CuFe + CuSO_{4}
Điều này chứng tỏ rằng sắt có tính khử mạnh.
IV. Trạng Thái Tự Nhiên
Trong tự nhiên, sắt không tồn tại dưới dạng nguyên tố tự do mà chủ yếu xuất hiện trong các hợp chất, đặc biệt là trong quặng sắt. Một số loại quặng sắt chính bao gồm:
Hematit: Hematit đỏ (Fe2O3 khan) và Hematit nâu (Fe2O3.nH2O).
Manhetit: (Fe3O4)
Xiđerit: (FeCO3)
Pirit: (FeS2)
Sắt cũng có mặt trong hồng cầu của máu, đóng vai trò quan trọng trong việc vận chuyển oxy tới các tế bào trong cơ thể.
Điều Chế
Sắt thường được điều chế qua phương pháp nhiệt luyện, trong đó quặng sắt được khử bằng cacbon trong lò cao.
Fe2O3+3CO→2Fe+3CO2Fe2O3 + 3CO
Ứng Dụng
Sắt có rất nhiều ứng dụng trong đời sống, nhưng chủ yếu được sử dụng để sản xuất thép và gang. Thép là vật liệu chủ yếu trong xây dựng và sản xuất máy móc, xe cộ.
Sắt đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống hàng ngày. Chủ yếu, nó được sử dụng để sản xuất thép và gang, hai vật liệu không thể thiếu trong ngành xây dựng và sản xuất công nghiệp. Thép, với độ bền cao và khả năng chống ăn mòn, là vật liệu chủ yếu được ứng dụng trong xây dựng công trình, từ những tòa nhà chọc trời cho đến cầu, đường và hạ tầng giao thông. Ngoài ra, thép cũng được dùng để chế tạo các thiết bị máy móc, phương tiện giao thông như ô tô, xe máy, giúp nâng cao hiệu suất và độ an toàn.
Khám phá ngay chuyên mục “Tài liệu hóa học phổ thông” để nắm vững kiến thức từ cơ bản đến nâng cao!

Bên cạnh đó, sắt còn có mặt trong nhiều vật dụng hàng ngày, từ đồ gia dụng như nồi, chảo đến các thiết bị điện tử. Nhờ vào tính năng bền bỉ và khả năng gia công dễ dàng, sắt trở thành lựa chọn hàng đầu cho nhiều sản phẩm tiêu dùng. Sự kết hợp giữa tính bền và khả năng tái chế của sắt cũng giúp nó trở thành một trong những vật liệu thân thiện với môi trường, khi nhiều sản phẩm từ sắt có thể được tái sử dụng và tái chế sau khi không còn sử dụng. Tóm lại, sắt không chỉ là một nguyên tố hóa học quan trọng mà còn là nền tảng cho nhiều sản phẩm và ứng dụng thiết yếu trong đời sống hiện đại.
Ngoài ra, sắt còn có mặt trong nhiều vật dụng hàng ngày như ô tô, xe máy và đồ gia dụng, nhờ vào tính năng bền bỉ và khả năng gia công dễ dàng của nó.
Các Hợp Chất Quan Trọng Của Fe
Hợp Chất Sắt (II)
Sắt (II) oxit (FeO)
Sắt (II) hiđroxit (Fe(OH)2)
Muối sắt (II): Fe2+: FeCl2, Fe(NO3)2…
Hợp Chất Sắt (III)
Sắt (III) oxit (Fe2O3)
Sắt (III) hiđroxit (Fe(OH)3)
Muối sắt (III): Fe3+: FeCl3, Fe(NO3)3…
Sắt không chỉ là một nguyên tố hóa học quan trọng mà còn là một phần không thể thiếu trong đời sống hàng ngày. Tính chất hóa học của sắt cùng với những ứng dụng phong phú của nó đã tạo ra những bước tiến đáng kể trong công nghiệp và đời sống. Hy vọng rằng qua bài viết này, bạn đã có cái nhìn rõ hơn về tính chất và vai trò của sắt trong tự nhiên và cuộc sống.
Có thể bạn quan tâm: