Nguyên tố Br – hay còn gọi là Brom – là một trong những nguyên tố phi kim quan trọng, thường xuất hiện trong sách giáo khoa hóa học phổ thông và cả trong cuộc sống hàng ngày. Với đặc điểm nổi bật là chất lỏng bay hơi có màu nâu đỏ đặc trưng, brom không chỉ thu hút bởi vẻ ngoài mà còn bởi những ứng dụng phong phú trong công nghiệp, y học và môi trường. Trong bài viết này, chúng ta sẽ khám phá toàn diện về nguyên tố Br: từ cấu tạo nguyên tử, vị trí trong bảng tuần hoàn, cho đến các phản ứng đặc trưng và vai trò thực tiễn.
Với đặc tính tương tự nhóm halogen như clo hay iot, Brom tạo ra những phản ứng thú vị, đồng thời đặt ra nhiều câu hỏi học thuật cho học sinh và giáo viên hóa học. Nếu từng tò mò “Br là nguyên tố gì?”, “Br có độc không?”, hay “Brom có tác dụng trong đời sống ra sao?”, thì bài viết này chính là lời giải đầy đủ và dễ hiểu.
Để hiểu sâu hơn về các nguyên tố halogen, bạn có thể tham khảo thêm bài viết chuyên sâu về nguyên tố iot, vốn được ứng dụng rộng rãi trong y tế và dinh dưỡng.
TÓM TẮT
- 1 1. Nguyên tố Br là gì?
- 2 2. Br có độc không? Những điều cần biết
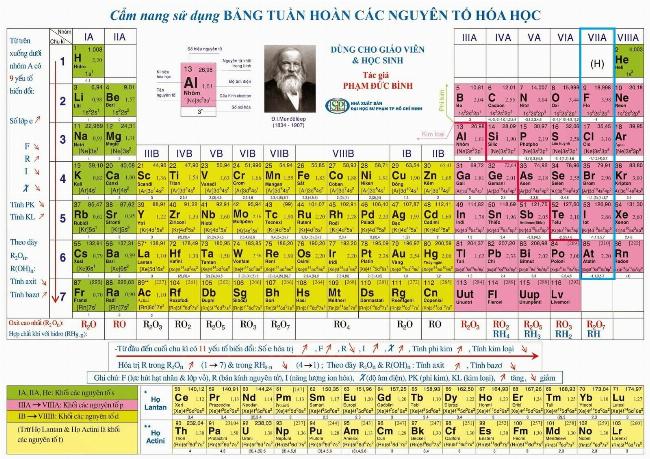
- 3 3. Brom nằm ở đâu trong bảng tuần hoàn?
- 4 4. Tính chất hóa học đặc trưng của nguyên tố Br
- 5 5. Ứng dụng của nguyên tố brom trong đời sống
- 6 6. Những câu hỏi thường gặp về nguyên tố Br
- 7 7. Từ brom đến hóa học thực hành: Tư duy liên kết
- 8 Kết luận
1. Nguyên tố Br là gì?
Brom là nguyên tố thuộc nhóm halogen
Nguyên tố Br, ký hiệu hóa học là Br, có số hiệu nguyên tử là 35, thuộc nhóm VIIA (17) trong bảng tuần hoàn – tức nhóm halogen, cùng họ với clo (Cl), flo (F) và iot (I). Ở điều kiện thường, brom tồn tại dưới dạng chất lỏng màu nâu đỏ, bay hơi mạnh và có tính ăn mòn, độc hại.
TS. Nguyễn Thị Mai Lan – chuyên gia hóa vô cơ tại Viện Hóa học Việt Nam chia sẻ:
“Brom là nguyên tố hiếm hoi ở trạng thái lỏng ở nhiệt độ phòng, tính chất này khiến nó trở nên độc đáo và đáng chú ý trong các thí nghiệm hóa học.“
Một số thông tin cơ bản về nguyên tố Br
| Thuộc tính | Giá trị/Thông tin |
|---|---|
| Ký hiệu hóa học | Br |
| Tên gọi | Brom (tiếng Anh: Bromine) |
| Số hiệu nguyên tử | 35 |
| Cấu hình electron | [Ar] 3d10 4s2 4p5 |
| Khối lượng mol | khoảng 79.90 g/mol |
| Trạng thái vật lý | Chất lỏng bay hơi |
| Màu sắc | Nâu đỏ |
| Mùi | Hắc, khó chịu, độc |
| Nhóm / Phân loại | Halogen (phi kim mạnh) |
| Nhiệt độ sôi | 58,8°C |
| Nhiệt độ nóng chảy | -7,2°C |
2. Br có độc không? Những điều cần biết
Brom độc hại như thế nào?
Câu trả lời là: có, nếu tiếp xúc trực tiếp hoặc hít phải hơi Br. Brom là chất oxy hóa mạnh có thể ăn mòn da và mô hô hấp. Do khả năng bay hơi tại điều kiện phòng, hít phải hơi brom trong thời gian dài có thể gây kích ứng phổi, ho, đau đầu, và nếu nồng độ cao có thể đe dọa tính mạng.
ThS. Trần Quốc Hưng – giảng viên Hóa học vô cơ tại Trường ĐH Sư phạm TP.HCM cảnh báo:
“Dù brom có nhiều ứng dụng hữu ích nhưng việc xử lý brom trong phòng thí nghiệm cần tuân thủ nghiêm ngặt quy trình an toàn. Mắt và da phải được bảo vệ tuyệt đối.“
3. Brom nằm ở đâu trong bảng tuần hoàn?
Brom nằm ở chu kỳ 4, nhóm VIIA, tức cột thứ 17 trong bảng tuần hoàn. Đây là nhóm chứa các nguyên tố halogen, đều có 7 electron ngoài cùng, mang xu hướng dễ nhận thêm 1 electron để đạt cấu hình bền.
| Nguyên tố cùng nhóm | Số hiệu nguyên tử | Trạng thái vật lý |
|---|---|---|
| Flo (F) | 9 | Khí |
| Clo (Cl) | 17 | Khí |
| Brom (Br) | 35 | Lỏng |
| Iot (I) | 53 | Rắn (dạng tinh thể) |
| Atatin (At) | 85 | Rắn, phóng xạ |
Để hiểu rõ hơn về thành phần và hóa tính đặc trưng của nhóm này, bạn có thể khám phá thêm tại bài viết về chromium là nguyên tố gì, một kim loại chuyển tiếp có tính oxy hóa thú vị.
4. Tính chất hóa học đặc trưng của nguyên tố Br
4.1 Tính oxi hóa mạnh
Là một halogen, brom có khả năng oxi hóa các ion kim loại thấp hơn, điển hình như sắt(II), kẽm, hoặc đồng(I):
Br2 + 2Fe2+ → 2Fe3+ + 2Br−4.2 Tác dụng với hidro
Khi phản ứng với hidro (H2) ở điều kiện có xúc tác và chiếu sáng:
Br2 + H2 → 2HBr→ Đây là phản ứng tỏa nhiệt, tạo ra axit bromhydric (HBr) – một axit mạnh.
4.3 Phản ứng với các hợp chất hữu cơ
Brom được sử dụng để brom hóa các hợp chất hữu cơ – phản ứng phổ biến trong nghiên cứu và sản xuất thuốc:
CH2=CH2 + Br2 → BrCH2–CH2Br→ Xác định liên kết đôi nhờ phản ứng mất màu của brom cũng là một hiện tượng thú vị trong thực hành thí nghiệm.
5. Ứng dụng của nguyên tố brom trong đời sống
Brom có mặt trong nhiều lĩnh vực khác nhau, từ công nghiệp đến nghiên cứu và sức khỏe. Dưới đây là một số ứng dụng nổi bật:
5.1 Trong công nghiệp
- Chất chống cháy (flame retardants): Dẫn xuất brom hữu cơ được dùng trong sản xuất vật liệu nhựa, vải dễ cháy.
- Nhiếp ảnh truyền thống: Dùng trong muối bạc brom (AgBr), giúp tạo ảnh trên phim.
- Làm chất diệt khuẩn và xử lý nước hồ bơi, nhờ tính oxi hóa diệt vi sinh hiệu quả.
5.2 Trong hóa học và nghiên cứu
- Dung môi và chất phản ứng brom hóa trong hóa hữu cơ.
- Phân tích phẩm màu và liên kết đôi trong nghiên cứu hóa học.
Hiện tượng brom mất màu khi phản ứng với liên kết đôi tương tự với tổng hợp các chất làm đổi màu quỳ tím, rất hữu ích trong thực hành nhận biết nhóm chức.
5.3 Trong y học
- Hợp chất bromua natri (NaBr) từng được dùng làm thuốc an thần nhẹ trong thế kỷ 19, mặc dù hiện nay ít phổ biến do tác dụng phụ.
- Dược phẩm chứa dẫn xuất brom vẫn được nghiên cứu để điều trị co giật và lo âu.
6. Những câu hỏi thường gặp về nguyên tố Br
Tại sao brom là chất lỏng còn clo thì là khí?
Do Br có khối lượng phân tử lớn hơn, lực hút phân tử giữa các phân tử Br2 lớn hơn dẫn đến điểm sôi cao hơn → brom tồn tại ở dạng lỏng, trong khi clo tồn tại ở thể khí.
Brom có thể ăn da không?
Có. Tiếp xúc trực tiếp brom lỏng có thể gây bỏng hóa học và tổn thương da.
Muối bromua có độc không?
Tùy vào hợp chất cụ thể. Một số muối bromua ít độc và từng được dùng trong y tế, nhưng cần sử dụng đúng liều và kiểm soát.
7. Từ brom đến hóa học thực hành: Tư duy liên kết
Sự hiểu biết về brom không chỉ giới hạn ở lý thuyết. Trong các bài tập trắc nghiệm, brom thường xuất hiện trong các câu hỏi liên quan đến phản ứng nhận biết, phản ứng tỏa nhiệt và quy luật biến đổi tuần hoàn của nhóm halogen.
Ngoài ra, để mở rộng kiến thức về các nguyên tố khác ít được nhắc đến nhưng vẫn có vai trò thú vị trong hóa học, bạn có thể xem thêm về nguyên tố re, một kim loại chuyển tiếp hiếm gặp nhưng đầy ứng dụng, hoặc bài viết giải thích nb là nguyên tố gì để làm rõ hơn về nhóm nguyên tố ở khối d.
 Nguyên tố Br có màu nâu đỏ nổi bật và phản ứng đặc trưng với hidro, kim loại
Nguyên tố Br có màu nâu đỏ nổi bật và phản ứng đặc trưng với hidro, kim loại
Kết luận
Nguyên tố Br – brom – tuy đứng không quá nổi bật trong bảng tuần hoàn như clo hay iot, nhưng lại là mắt xích quan trọng trong nhóm halogen nhờ tính chất riêng biệt như tồn tại ở thể lỏng và khả năng phản ứng linh hoạt. Việc hiểu rõ về nguyên tố Br giúp học sinh, giáo viên và người yêu hóa học không chỉ chinh phục điểm số mà còn xây dựng nền tảng kiến thức bền vững, chính xác và thực tiễn.
Từ lý thuyết đến ứng dụng, từ phòng thí nghiệm đến cuộc sống, brom luôn mở ra nhiều hướng khám phá hấp dẫn. Nếu bạn muốn tiếp tục hành trình hóa học thú vị, đừng ngần ngại tìm đọc thêm về các nguyên tố cùng nhóm hoặc đặt câu hỏi để Hóa Học Phổ Thông tiếp tục đồng hành cùng bạn nhé.
Hãy chia sẻ bài viết này nếu bạn thấy hữu ích – vì hóa học không chỉ là môn học, mà còn là hành trình khám phá thế giới quanh ta!










