Tính chất hóa học của Sunfua – Lưu huỳnh (S) và hiđro sunfua (H2S) là hai chất quan trọng trong hóa học, có nhiều ứng dụng trong công nghiệp và đời sống. Bài viết này sẽ cung cấp cho các bạn học sinh – sinh viên cái nhìn toàn diện về tính chất vật lí, hóa học, phương pháp điều chế và ứng dụng của hai chất này, kèm theo những phương pháp giải bài tập cụ thể, giúp các bạn tự tin hơn khi học và làm bài tập. Khám phá ngay cùng hoahocphothong nhé!
TÓM TẮT
Tính chất hóa học của Sunfua (S) & tính chất vật lý
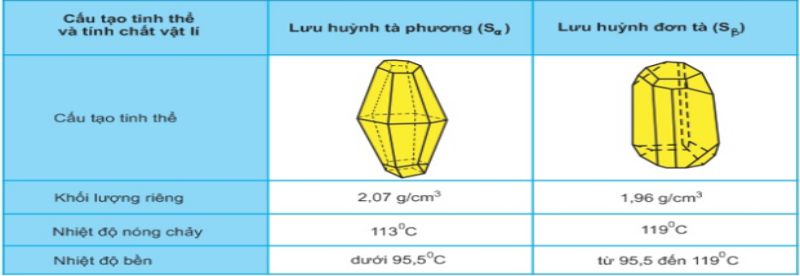
I. Tính chất vật lí của Lưu huỳnh
Lưu huỳnh (S) tồn tại dưới hai dạng thù hình: lưu huỳnh tà phương (Sα) và lưu huỳnh đơn tà (Sβ). Hai dạng này có sự khác biệt về cấu trúc tinh thể và một số tính chất vật lí, tuy nhiên tính chất hóa học lại tương tự nhau. Nhiệt độ đóng vai trò quan trọng trong sự chuyển đổi giữa hai dạng thù hình này.
- Ở nhiệt độ dưới 113°C, lưu huỳnh ở dạng rắn, có màu vàng và cấu trúc phân tử là chuỗi vòng với 8 nguyên tử (S8).
- Khi nhiệt độ đạt 119°C, lưu huỳnh nóng chảy và trở thành chất lỏng màu vàng.
- Nhiệt độ cao hơn, khoảng 187°C, lưu huỳnh chuyển thành chất lỏng màu nâu đỏ có độ quánh nhớt cao.
- Ở 445°C, lưu huỳnh sôi và phân tử S bị đứt gãy thành các phân tử nhỏ hơn, dễ bay hơi. Khi nhiệt độ đạt 1700°C, lưu huỳnh chỉ tồn tại ở dạng nguyên tử S.
Tính chất hóa học của Sunfua (S)
Tính chất hóa học của muối sunfua đó là tác dụng với kim loại và hidro:
Lưu huỳnh có tính oxi hóa mạnh khi phản ứng với kim loại và hidro:
Tác dụng với hidro:
H2 + S → H2S (350°C)
Tác dụng với kim loại:
Lưu huỳnh phản ứng với kim loại tạo ra sunfua kim loại, điển hình như: Fe + S → FeS.
Tác dụng với phi kim và hợp chất
Trong một số phản ứng, lưu huỳnh thể hiện tính khử mạnh khi tác dụng với phi kim và các chất oxi hóa mạnh, ví dụ như phản ứng với oxi tạo ra lưu huỳnh đioxit: S + O2 → SO2.
Ứng dụng của Lưu huỳnh
Lưu huỳnh là nguyên liệu thiết yếu trong nhiều ngành công nghiệp:
Sản xuất axit sunfuric (H2SO4).
Lưu hóa cao su.
Chế tạo diêm, sản xuất chất tẩy trắng, dược phẩm, phẩm nhuộm, chất trừ sâu, …
Phương pháp điều chế Lưu huỳnh
Khai thác tự nhiên
Lưu huỳnh tự do được khai thác từ lòng đất bằng phương pháp Frasch.
Sản xuất từ hợp chất
Phương pháp đốt H2S trong điều kiện thiếu không khí: 2H2S + O2 → 2S + 2H2O.
Tính chất của Hiđro sunfua (H2S)
Cấu tạo phân tử
Hiđro sunfua có cấu trúc tương tự nước (H2O), với lưu huỳnh có số oxi hóa -2. Phân tử H2S được hình thành từ liên kết cộng hóa trị giữa hai nguyên tử H và một nguyên tử S.
Tính chất vật lí của Hiđro sunfua
H2S là một chất khí không màu, rất độc, có mùi trứng thối đặc trưng và nặng hơn không khí.
Khí H2S hóa lỏng ở -60°C và hóa rắn ở -86°C. H2S có độ tan trong nước khá thấp (0,38g/100g H2O ở 20°C).
Tính chất hóa học của Hiđro sunfua
Tính axit yếu
H2S tan trong nước tạo thành dung dịch axit sunfuhiđric (H2S), có tính axit rất yếu. Nó tác dụng với kiềm để tạo ra hai loại muối là muối trung hòa (Na2S) và muối axit (NaHS).
Tính khử mạnh
Trong các phản ứng hóa học, H2S thể hiện tính khử mạnh do lưu huỳnh có số oxi hóa thấp nhất (-2). Tùy theo điều kiện phản ứng mà H2S có thể bị oxi hóa thành S0, S+4 hoặc S+6. Ví dụ, khi cháy trong không khí, H2S bị oxi hóa tạo ra SO2: 2H2S + 3O2 → 2SO2 + 2H2O.
Khám phá ngay chuyên mục “Tài liệu Hóa Học Phổ Thông” để nắm vững kiến thức từ cơ bản đến nâng cao!

Ứng dụng và điều chế Hiđro sunfua
Mặc dù hiđro sunfua (H2S) là một chất khí độc, có mùi trứng thối và nguy hiểm cho sức khỏe nếu tiếp xúc ở nồng độ cao, nhưng nó vẫn được sử dụng trong một số ngành công nghiệp và lĩnh vực khác nhau nhờ những tính chất hóa học đặc trưng của nó:
Sản xuất hóa chất:
H2S được sử dụng làm nguyên liệu để sản xuất axit sunfuric (H2SO4) thông qua quá trình oxi hóa lưu huỳnh. Axit sunfuric là một chất quan trọng trong nhiều ngành công nghiệp, từ chế tạo phân bón, luyện kim đến sản xuất hóa chất công nghiệp.
Làm chất khử:
Với tính khử mạnh, H2S được sử dụng trong các phản ứng hóa học để khử các hợp chất kim loại nặng, ví dụ như làm giảm các oxit kim loại xuống dạng kim loại nguyên chất.
Phân tích hóa học:
Hiđro sunfua thường được sử dụng trong các phòng thí nghiệm hóa học để nhận biết các ion kim loại nặng. Các ion này sẽ tạo ra những kết tủa sunfua đặc trưng có màu sắc khác nhau. Ví dụ, CuS có màu đen, CdS có màu vàng.
Sản xuất khí trơ và hợp chất lưu huỳnh:
H2S cũng được dùng để sản xuất lưu huỳnh nguyên chất trong một số quy trình công nghiệp, đặc biệt là thu hồi lưu huỳnh từ khí thải.
Chất bảo vệ môi trường:
Trong công nghiệp, H2S được ứng dụng để loại bỏ các hợp chất lưu huỳnh trong khí thải nhằm giảm thiểu ô nhiễm môi trường, đồng thời thu hồi lưu huỳnh trong các quá trình công nghiệp.
Điều chế Hiđro sunfua (H2S)
Hiđro sunfua (H2S) có thể được điều chế từ nhiều nguồn khác nhau trong tự nhiên hoặc thông qua các phản ứng hóa học nhân tạo. Tuy nhiên, do tính độc hại và nguy hiểm của nó, việc điều chế H2S cần phải được thực hiện dưới điều kiện an toàn nghiêm ngặt.
- Trong tự nhiên:
H2S có mặt trong tự nhiên ở những vùng núi lửa, suối nước nóng, và trong quá trình phân hủy các hợp chất protein (chủ yếu từ các sinh vật chết hoặc thực vật phân hủy). Khí này thoát ra từ các quá trình sinh hóa tự nhiên và tồn tại ở nồng độ thấp trong không khí. - Trong công nghiệp:
Mặc dù H2S không được sản xuất trực tiếp trên quy mô công nghiệp vì tính độc hại, nhưng nó có thể được thu hồi từ quá trình xử lý dầu mỏ, khí tự nhiên hoặc quá trình sản xuất các hợp chất lưu huỳnh. Các nhà máy lọc dầu và công nghiệp khí đốt thường xử lý H2S như một sản phẩm phụ và chuyển hóa nó thành lưu huỳnh hoặc các hợp chất khác.
Điều chế từ hợp chất lưu huỳnh:
Một phương pháp khác để điều chế H2S là thông qua quá trình đốt cháy khí lưu huỳnh hiđrua trong điều kiện thiếu không khí hoặc tác dụng với các chất oxi hóa mạnh trong điều kiện kiểm soát.
Tính chất của muối sunfua
Muối sunfua của các kim loại nhóm IA và IIA thường tan trong nước và phản ứng với axit mạnh để giải phóng H2S. Tuy nhiên, các muối sunfua của kim loại nặng như PbS và CuS không tan trong nước và cũng không tác dụng với axit loãng. Một số muối sunfua có màu đặc trưng, như CuS và Ag2S có màu đen, CdS có màu vàng.
Bài viết trên không chỉ cung cấp kiến thức cơ bản tính chất hóa học của sunfua, mà còn giúp các bạn ôn tập và chuẩn bị tốt hơn cho các bài kiểm tra. Hy vọng rằng những nội dung chi tiết này sẽ giúp các bạn tự tin hơn khi học môn Hóa học!
Có thể bạn quan tâm:










