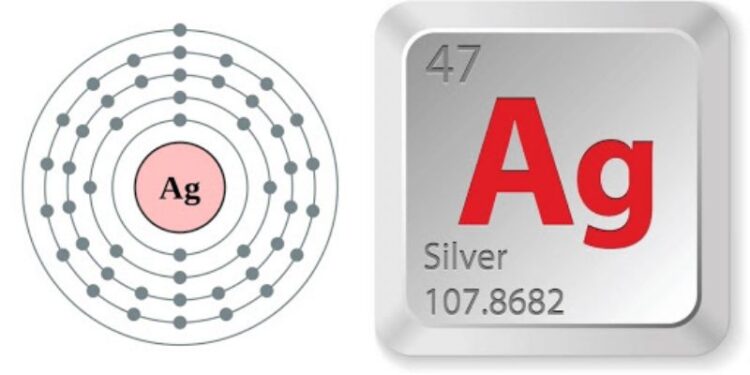
Bạc, với ký hiệu hóa học Ag và số hiệu nguyên tử 47, là một kim loại quý có lịch sử dài và quý giá. Từ thời kỳ tiền sử, con người đã biết đến bạc, và các chứng cứ khảo cổ cho thấy bạc đã được tách ra từ chì từ thiên niên kỷ thứ 4 trước Công nguyên tại các khu vực như Tiểu Á và các hòn đảo thuộc biển Aegean. Bạc không chỉ thu hút ánh nhìn bởi vẻ đẹp của nó mà còn vì tính chất hóa học của bạc độc đáo, khiến nó trở thành một trong những kim loại quan trọng trong công nghiệp và đời sống. Tìm hiểu thêm cùng hoahocphothong nhé!
- Ký hiệu: Ag
- Cấu hình electron: [Kr] 4d10 5s1
- Khối lượng nguyên tử: 108 g/mol
- Vị trí trong bảng tuần hoàn:
- Ô: 47
- Nhóm: IB
- Chu kỳ: 5
- Độ âm điện: 1,93
TÓM TẮT
II. Tính Chất hóa học của bạc & Vật Lý
Tính Chất Vật Lý
Bạc là một kim loại mềm và dẻo, dễ dàng được kéo sợi hoặc dát mỏng. Với màu trắng bóng, bạc có khả năng dẫn điện và dẫn nhiệt tốt nhất trong số các kim loại. Khối lượng riêng của bạc là 10,49 g•cm−3, trong khi nhiệt độ nóng chảy của nó đạt 960,5 °C, làm cho bạc trở thành một vật liệu lý tưởng cho nhiều ứng dụng công nghiệp.
Nhận Biết
Bạc có thể dễ dàng nhận biết qua sự thay đổi màu sắc. Khi dẫn khí ozon (O3) vào bạc kim loại, bạc chuyển từ màu trắng sáng sang màu đen do phản ứng hóa học xảy ra:
O3 + 2Ag → Ag2O + O2
Ngoài ra, bạc cũng sẽ chuyển sang màu đen khi tiếp xúc với không khí hoặc nước có chứa hidro sulfua:
4Ag + 2H2S + O2 (kk) → 2Ag2S + 2H2O
Tính Chất Hóa Học của Bạc
Tính Chất Hoá Học của bạc Cơ Bản
Tính chất hóa học của kim loại Bạc là tính chất kém hoạt động. Khi tiếp xúc với môi trường, bạc không bị oxy hóa trong không khí dù ở nhiệt độ cao. Tuy nhiên, nó có thể phản ứng với một số chất hóa học khác:
Tác dụng với phi kim: Bạc có khả năng phản ứng với ozon, tạo thành bạc oxit:
2Ag + O3 → Ag2O + O2
Tác dụng với axit
Bạc không phản ứng với axit HCl và H2SO4 loãng, nhưng có thể tác dụng với các axit có tính oxy hóa mạnh như HNO3 hoặc H2SO4 đặc và nóng:
3Ag + 4HNO3 (loãng) → 3AgNO3 + NO + 2H2O
2Ag + 2H2SO4 (đặc, nóng) → Ag2SO4 + SO2 + 2H2O
Tác dụng với các chất khác
Khi tiếp xúc với hidro sulfua, bạc sẽ tạo thành bạc sulfua, khiến nó trở nên đen:
4Ag + 2H2S + O2 (kk) → 2Ag2S + 2H2O
Bạc cũng có thể phản ứng với axit hydrofluoric (HF) trong sự hiện diện của oxy già (H2O2), dẫn đến việc hình thành các muối bạc như bạc florua (AgF).
Trạng Thái Tự Nhiên
Trong tự nhiên, bạc tồn tại chủ yếu dưới dạng hỗn hợp của hai đồng vị ổn định là Ag107 và Ag109, trong đó Ag107 phổ biến hơn. Bạc thường được tìm thấy trong các khoáng chất như argentit (Ag2S) và silver horn (AgCl), thường kết hợp với các nguyên tố như lưu huỳnh, asen, và antimoan. Các nguồn bạc chủ yếu hiện nay đến từ các khoáng chất chứa đồng, vàng và chì, có mặt tại các quốc gia như Canada, Mexico, Peru, Úc và Mỹ.
Điều Chế
Bạc thường được sản xuất từ quặng bạc thông qua quy trình tinh chế phức tạp. Một trong những phương pháp phổ biến nhất là điện phân, cho phép tách bạc ra khỏi các tạp chất một cách hiệu quả.
Quá trình này bắt đầu bằng việc nghiền và hòa tan quặng bạc trong dung dịch axit hoặc các hóa chất phù hợp, để tạo ra một dung dịch chứa bạc. Sau đó, dung dịch này sẽ được đưa vào một tế bào điện phân, nơi các ion bạc sẽ di chuyển tới cực âm (catot) và lắng đọng lại thành bạc kim loại tinh khiết.
Quá trình điện phân không chỉ giúp loại bỏ các tạp chất mà còn giúp thu hồi bạc một cách an toàn và hiệu quả. Ngoài ra, bạc cũng có thể được chiết xuất từ các quặng chứa kim loại khác, như đồng hoặc vàng, thông qua các phương pháp hóa học khác, nhằm tối ưu hóa năng suất và độ tinh khiết của bạc.
Với những công nghệ hiện đại, quá trình điều chế bạc ngày càng trở nên chính xác và tiết kiệm năng lượng hơn, đồng thời bảo vệ môi trường bằng cách giảm thiểu chất thải và ô nhiễm.
Khám phá ngay chuyên mục “Tài liệu Hóa Học Phổ Thông” để nắm vững kiến thức từ cơ bản đến nâng cao!

Ứng Dụng
Bạc có nhiều ứng dụng quan trọng trong cuộc sống hàng ngày và công nghiệp. Một số ứng dụng nổi bật bao gồm:
- Nguyên liệu quý: Bạc được xem là một trong những kim loại quý, thường được dùng để chế tạo trang sức, đồ bạc và các sản phẩm nghệ thuật.
- Ngành điện và điện tử: Do tính dẫn điện cao, bạc thường được sử dụng trong các sản phẩm điện và điện tử, bao gồm công tắc và mạch điện.
- Gương và phản xạ ánh sáng: Bạc được sử dụng trong sản xuất gương do khả năng phản xạ ánh sáng tốt.
- Bạc nitrat: Đây là một hợp chất phổ biến trong ngành công nghiệp phim ảnh và được sử dụng trong nhiều quy trình hóa học khác nhau.
- Pin và que hàn: Bạc cũng được ứng dụng trong các loại pin dung tích lớn như pin bạc-kẽm và bạc-cadmi, cùng với việc sản xuất que hàn trong ngành chế tạo máy móc.
- Các ứng dụng y tế: Bạc có tính kháng khuẩn, nên được sử dụng trong một số sản phẩm y tế và băng vết thương.
Ngoài ra, bạc còn có nhiều hợp chất quan trọng như:
- Bạc clorua (AgCl)
- Bạc bromua (AgBr)
- Bạc nitrat (AgNO3)
Kết Luận
Bạc không chỉ là một kim loại quý giá trong cuộc sống mà còn là một nguyên liệu không thể thiếu trong nhiều lĩnh vực công nghiệp và nghiên cứu khoa học. Với những đặc tính vượt trội, bạc đã khẳng định vị trí của mình trong bảng tuần hoàn và trong đời sống hàng ngày. Việc hiểu rõ về tính chất hóa học và ứng dụng của bạc không chỉ giúp sinh viên có cái nhìn sâu sắc hơn về hóa học mà còn mở ra những cơ hội nghiên cứu và phát triển trong tương lai.
Có thể bạn quan tâm: