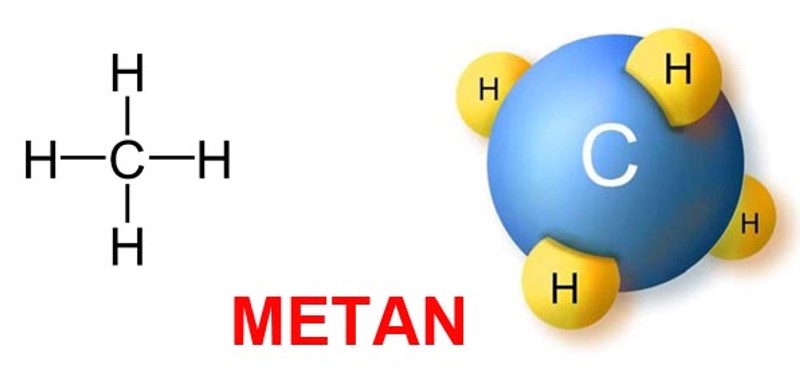
Metan (CH₄) là một trong những hợp chất hữu cơ đơn giản nhất và phổ biến nhất trên Trái đất, được tìm thấy nhiều trong tự nhiên và là thành phần chính của khí thiên nhiên. Không chỉ quen thuộc trong đời sống hàng ngày, Metan còn đóng vai trò quan trọng trong nhiều ngành công nghiệp và nghiên cứu khoa học. Dưới đây, chúng ta sẽ cùng Hóa Học Phổ Thông tìm hiểu chi tiết về tính chất hóa học của Metan, các phản ứng đặc trưng cũng như ứng dụng của nó trong cuộc sống.
Tính chất hóa học của Metan
Metan tác dụng với Oxi (Phản ứng cháy)
Metan là một chất khí có tính chất hóa học của ankan đó là dễ bắt cháy và có khả năng tạo ra một lượng nhiệt lớn khi đốt trong không khí hoặc oxi. Đây là phản ứng phổ biến nhất của Metan trong đời sống, đặc biệt được ứng dụng trong các thiết bị sử dụng khí gas như bếp gas. Phương trình hóa học phản ứng cháy của Metan như sau:
CH4+2O2⟶nhiệt độCO2+2H2OCH_4 + 2O_2 \overset{\text{nhiệt độ}}{\longrightarrow} CO_2 + 2H_2OCH4+2O2⟶nhiệt độCO2+2H2O
Trong phản ứng này, Metan kết hợp với oxi ở nhiệt độ cao để tạo ra hai chất mới là khí carbon dioxide (CO₂) và hơi nước (H₂O). Lượng nhiệt sinh ra từ phản ứng này rất lớn, đó là lý do tại sao Metan được sử dụng rộng rãi làm nguồn nhiên liệu cho việc đun nấu và phát điện.
Metan tác dụng với Clo (Phản ứng thế)
Ngoài phản ứng cháy, Metan còn có khả năng phản ứng với clo trong điều kiện có ánh sáng chiếu vào. Đây là một ví dụ điển hình của phản ứng thế, khi một nguyên tử hydro trong phân tử Metan bị thay thế bởi một nguyên tử clo. Phương trình phản ứng cụ thể như sau:
CH4+Cl2⟶aˊnh saˊngCH3Cl+HClCH_4 + Cl_2 \overset{\text{ánh sáng}}{\longrightarrow} CH_3Cl + HClCH4+Cl2⟶aˊnh saˊngCH3Cl+HCl
Trong phản ứng này, Metan và clo tạo thành metyl clorua (CH₃Cl) và axit clohidric (HCl). Phản ứng này được gọi là phản ứng thế vì một nguyên tử hydro trong Metan bị thay thế bởi một nguyên tử clo. Đây là một phản ứng quan trọng trong công nghiệp hóa chất, đặc biệt trong quá trình sản xuất các dẫn xuất clo của Metan.
Tính cháy dễ dàng của Metan
Một đặc tính quan trọng khác trong tính chất hóa học của Metan là khả năng dễ cháy. Khi Metan tiếp xúc với nguồn nhiệt hoặc tia lửa trong không khí, nó có thể dễ dàng bốc cháy và tạo ra các sản phẩm như CO₂ và H₂O như đã đề cập ở trên. Tuy nhiên, trong một số trường hợp, nếu không đủ oxi, Metan có thể tạo ra khí độc carbon monoxide (CO), gây nguy hiểm cho sức khỏe con người. Điều này giải thích vì sao trong các khu vực khai thác dầu khí hoặc than đá, việc kiểm soát lượng Metan trong không khí là vô cùng quan trọng để tránh nguy cơ cháy nổ và ngộ độc khí.
Ứng dụng của Metan trong đời sống
Metan làm nhiên liệu
Metan là thành phần chính trong khí thiên nhiên, một trong những nguồn năng lượng quan trọng nhất trên thế giới. Nhờ vào khả năng cháy dễ dàng và sinh nhiệt lớn, khí Metan được sử dụng rộng rãi trong đời sống hàng ngày. Ví dụ phổ biến nhất là việc sử dụng khí gas trong bếp nấu ăn. Không chỉ dừng lại ở việc nấu nướng, Metan còn được sử dụng trong các nhà máy phát điện và hệ thống sưởi ấm, cung cấp năng lượng cho hàng triệu hộ gia đình và cơ sở sản xuất trên toàn cầu.
Khám phá ngay chuyên mục “Tài liệu hóa học phổ thông” để nắm vững kiến thức từ cơ bản đến nâng cao!
Ứng dụng của Metan trong công nghiệp hóa học
Ngoài việc làm nhiên liệu, Metan còn là nguyên liệu quan trọng trong nhiều phản ứng hóa học để sản xuất các chất khác. Trong ngành công nghiệp hóa chất, Metan được sử dụng để tổng hợp các sản phẩm như methanol (CH₃OH), axit axetic (CH₃COOH), và đặc biệt là hydro (H₂). Hydro được sản xuất từ Metan thông qua quá trình reforming hơi nước, trong đó Metan phản ứng với nước ở nhiệt độ cao để tạo ra hydro và khí carbon dioxide:
CH4+H2O⟶nhiệt độCO+3H2CH_4 + H_2O \overset{\text{nhiệt độ}}{\longrightarrow} CO + 3H_2CH4+H2O⟶nhiệt độCO+3H2
Hydro thu được từ quá trình này là nguyên liệu quan trọng trong nhiều ngành công nghiệp, bao gồm sản xuất amoniac (NH₃) và các hợp chất hữu cơ khác.

Ứng dụng của Metan trong ngành công nghiệp năng lượng
Metan cũng đóng vai trò quan trọng trong việc sản xuất điện năng. Các nhà máy điện sử dụng khí thiên nhiên (chứa chủ yếu Metan) để chạy tua-bin khí, biến nhiệt năng thành điện năng. Ngoài ra, nhờ khả năng tạo ra ít khí thải hơn so với các loại nhiên liệu hóa thạch khác như than đá và dầu mỏ, Metan được coi là nguồn năng lượng sạch hơn và thân thiện với môi trường hơn.
Kết luận
Tính chất hóa học của Metan không chỉ giúp chúng ta hiểu rõ hơn về cách hoạt động của chất khí này mà còn mở ra nhiều ứng dụng thực tiễn trong các lĩnh vực khác nhau. Tuy nhiên, với tính dễ cháy và khả năng gây nguy hiểm trong một số điều kiện nhất định, việc sử dụng và khai thác Metan cần được kiểm soát chặt chẽ để đảm bảo an toàn cho con người và môi trường.