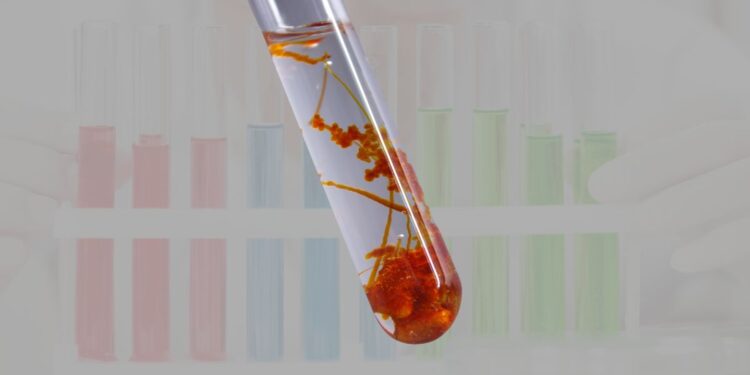
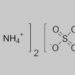
Phản ứng giữa NH3 (amoniac) và FeCl3 (sắt(III) clorua) là một thí nghiệm điển hình, thường được sử dụng trong các bài học hóa học để minh họa tính chất của các hợp chất vô cơ. Khi NH3 + FeCl3, có sự xuất hiện của kết tủa đặc trưng, giúp người học hiểu rõ hơn về quá trình tương tác giữa các ion trong dung dịch. Bên cạnh việc quan sát kết quả trực quan, theo Hóa Học Phổ Thông thì phản ứng này còn đóng vai trò quan trọng trong việc tìm hiểu tính chất hóa học và cơ chế của các chất tham gia.
TÓM TẮT
Phương trình hoá học giữa NH3 + FeCl3
Phản ứng giữa tính chất hóa học của nh3 (amoniac) và FeCl₃ (sắt(III) clorua) là một ví dụ điển hình về sự hình thành kết tủa trong hóa học vô cơ. Khi dung dịch amoniac được thêm vào dung dịch sắt(III) clorua, ion Fe³⁺ từ FeCl₃ sẽ phản ứng với các ion OH⁻ được tạo ra từ amoniac khi nó hòa tan trong nước. Kết quả của quá trình này là sự hình thành kết tủa sắt(III) hydroxit, Fe(OH)₃, có màu nâu đỏ, kèm theo dung dịch chứa muối amoni clorua, NH₄Cl. Phản ứng này không chỉ hấp dẫn về mặt thị giác mà còn giúp minh họa rõ ràng tính chất của các ion trong dung dịch.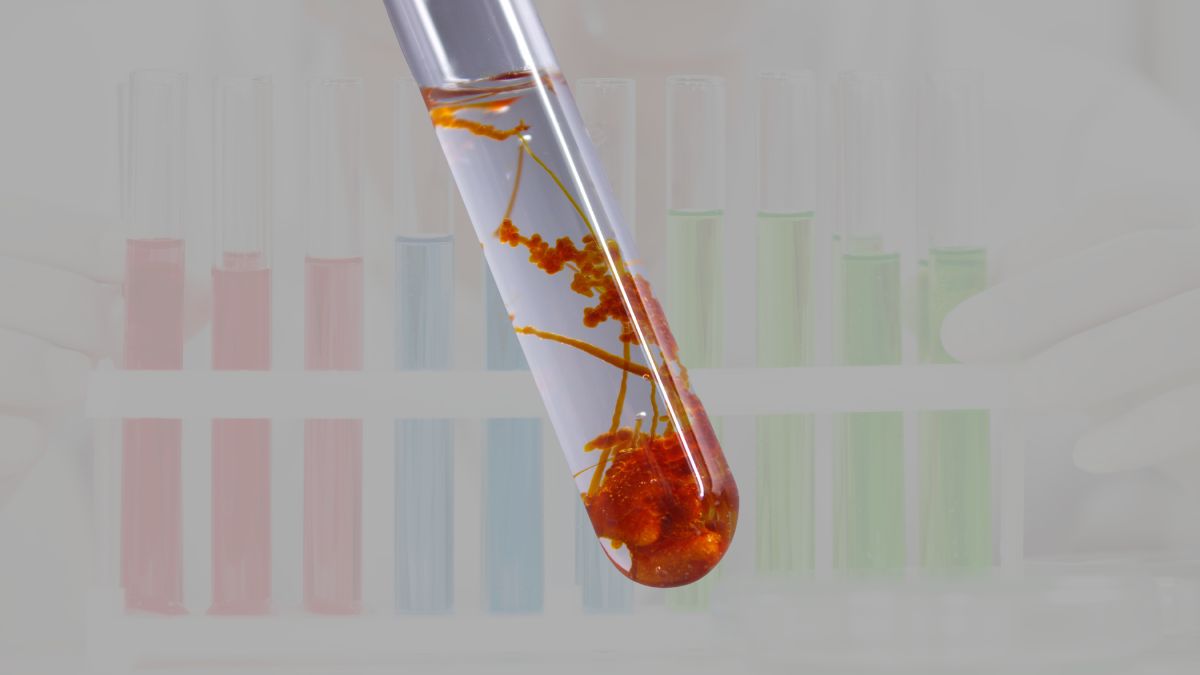
Phương trình hóa học đầy đủ của phản ứng có thể viết như sau:
FeCl3 (aq) + 3NH3 (aq) + 3H2O (l) → Fe(OH)3 (rắn) + 3NH4Cl (aq)
Giải thích phản ứng: FeCl₃, khi tan trong nước, phân ly thành các ion Fe³⁺ và Cl⁻. Ion Fe³⁺ có tính chất oxy hóa mạnh, sẵn sàng phản ứng với các ion OH⁻ để tạo ra kết tủa. NH₃ (amoniac) khi hòa tan trong nước có khả năng phản ứng với nước, tạo ra ion NH₄⁺ và OH⁻. Ion OH⁻ này sẽ tác dụng với Fe³⁺.
Phản ứng chính diễn ra là sự kết hợp giữa các ion Fe³⁺ và OH⁻, tạo ra Fe(OH)₃ (sắt(III) hydroxit), một hợp chất không tan trong nước và có màu nâu đỏ đặc trưng.
Sản phẩm phụ của phản ứng là NH₄Cl (amoni clorua), một muối tan trong nước.
Phương trình ion thu gọn biểu diễn quá trình chính:
Fe3 + (aq) + 3OH− (aq) → Fe(OH)3 (rắn)
Trong phương trình này, ta có thể thấy rõ phản ứng tạo thành kết tủa Fe(OH)₃, do ion Fe³⁺ kết hợp với các ion OH⁻. Kết tủa này có màu sắc dễ quan sát, giúp người học dễ dàng nhận biết phản ứng đã xảy ra.
Các thí nghiệm minh hoạ phản ứng NH3 + FeCl3
Thí nghiệm giữa NH3 + FeCl3 là một minh họa điển hình để quan sát phản ứng tạo kết tủa trong hóa học vô cơ. Các thí nghiệm này thường được tiến hành để thể hiện sự hình thành kết tủa sắt(III) hydroxit và sự thay đổi màu sắc đặc trưng. Dưới đây là một số thí nghiệm đơn giản để minh họa cho phản ứng này.
Thí nghiệm 1: Phản ứng tạo kết tủa sắt(III) hydroxit
Dụng cụ và hóa chất:
- Ống nghiệm
- Ống nhỏ giọt
- Dung dịch NH₃ (amoniac loãng)
- Dung dịch FeCl₃ (sắt(III) clorua loãng)
Tiến hành thí nghiệm:
- Chuẩn bị hai ống nghiệm. Trong mỗi ống, nhỏ vào khoảng 5 ml dung dịch FeCl₃ loãng.
- Sử dụng ống nhỏ giọt, nhỏ từ từ dung dịch NH₃ loãng vào mỗi ống nghiệm.
- Quan sát hiện tượng xảy ra trong ống nghiệm.
Hiện tượng:
- Ngay khi nhỏ NH₃ vào dung dịch FeCl₃, xuất hiện một kết tủa màu nâu đỏ. Kết tủa này chính là sắt(III) hydroxit, Fe(OH)₃.
- Dung dịch chuyển từ màu vàng nhạt (của dung dịch FeCl₃) sang vẩn đục do sự hình thành kết tủa.
Giải thích:
Amoniac khi tan trong nước tạo ra ion OH⁻, phản ứng với ion Fe³⁺ trong FeCl₃ để tạo ra kết tủa Fe(OH)₃. Phương trình phản ứng:
FeCl3 (aq) + 3NH3 (aq) + 3H2O (l) → Fe(OH)3 (rắn) + 3NH4Cl (aq)
Thí nghiệm 2: Ảnh hưởng của nồng độ NH₃ đến sự hình thành kết tủa
Dụng cụ và hóa chất:
- Ống nghiệm
- Dung dịch NH₃ loãng và dung dịch NH₃ đặc
- Dung dịch FeCl₃ loãng
Tiến hành thí nghiệm:
- Chuẩn bị hai ống nghiệm. Trong mỗi ống, thêm 5 ml dung dịch FeCl₃ loãng.
- Trong ống nghiệm thứ nhất, nhỏ từng giọt dung dịch NH₃ loãng vào.
- Trong ống nghiệm thứ hai, nhỏ dung dịch NH₃ đặc vào một cách từ từ.
- Quan sát hiện tượng trong từng ống nghiệm.
Khám phá ngay chuyên mục “Tài liệu hóa học phổ thông” để nắm vững kiến thức từ cơ bản đến nâng cao!
Hiện tượng:
- Ở ống nghiệm thứ nhất, khi nhỏ NH₃ loãng, một lượng kết tủa nâu đỏ xuất hiện từ từ.
- Ở ống nghiệm thứ hai, khi nhỏ NH₃ đặc, kết tủa xuất hiện ngay lập tức và với số lượng lớn hơn.
Giải thích: Nồng độ của NH₃ càng cao thì lượng ion OH⁻ sinh ra càng nhiều, từ đó phản ứng với ion Fe³⁺ càng mạnh và nhanh chóng tạo ra nhiều kết tủa Fe(OH)₃ hơn.
Thí nghiệm 3: Phản ứng trong điều kiện thay đổi nhiệt độ
Dụng cụ và hóa chất:
- Ống nghiệm
- Đèn cồn hoặc bếp đun
- Dung dịch FeCl₃
- Dung dịch NH₃ loãng
Tiến hành thí nghiệm:
- Cho 5 ml dung dịch FeCl₃ vào một ống nghiệm và đun nhẹ bằng đèn cồn cho đến khi dung dịch ấm.
- Sau đó, nhỏ từng giọt dung dịch NH₃ vào ống nghiệm khi dung dịch vẫn còn nóng.
- Quan sát sự thay đổi về màu sắc và sự hình thành kết tủa.
Hiện tượng: Kết tủa Fe(OH)₃ vẫn hình thành nhưng có thể ít hơn so với khi phản ứng diễn ra ở nhiệt độ phòng. Màu sắc của kết tủa có thể nhạt hơn.
Giải thích: Ở nhiệt độ cao, dung dịch trở nên bão hòa nhanh hơn, dẫn đến việc hình thành kết tủa Fe(OH)₃ có thể chậm lại hoặc giảm so với điều kiện nhiệt độ phòng.
Các thí nghiệm trên đều giúp người quan sát nắm bắt rõ hơn về bản chất của phản ứng giữa NH₃ và FeCl₃, đồng thời minh họa được sự thay đổi về tốc độ và lượng kết tủa phụ thuộc vào các điều kiện khác nhau như nồng độ và nhiệt độ.
Kết luận
Thí nghiệm minh họa phản ứng giữa NH₃ và FeCl₃ mang lại những hiểu biết sâu sắc về quá trình hình thành kết tủa và sự thay đổi màu sắc trong dung dịch. Đây không chỉ là một phản ứng mang tính ứng dụng cao trong thực tế mà còn là minh chứng rõ ràng về cách các chất hóa học tương tác với nhau. Qua phản ứng này, người học có cơ hội khám phá thêm nhiều khía cạnh về tính chất của amoniac và sắt(III) clorua, từ đó củng cố kiến thức nền tảng và phát triển tư duy logic trong hóa học.
Có thể bạn quan tâm: