Trong quá trình học và làm bài tập Hóa học, “công thức tính số mol” là một kiến thức cơ bản nhưng cực kỳ quan trọng. Hiểu đúng và vận dụng chính xác công thức này sẽ giúp bạn giải quyết nhanh gọn các bài toán liên quan đến chất, phản ứng và định lượng. Bài viết dưới đây không chỉ giúp bạn ghi nhớ công thức dễ dàng, mà còn hướng dẫn cách áp dụng hiệu quả vào các dạng bài tập thực tế.
Đối với những bạn đang tìm hiểu khái niệm nguyên tử, nguyên tố để nắm vững căn bản, có thể xem thêm bài viết liên quan tại nguyên tố là gì nguyên tử là gì.
TÓM TẮT
Mục tiêu tìm kiếm “công thức tính số mol” là gì?
Phân tích từ khóa “công thức tính số mol” cho thấy người dùng đang có ý định tìm thông tin kiến thức cụ thể, phù hợp cho mục tiêu học tập (học sinh, sinh viên), giảng dạy (giáo viên) hoặc củng cố hiểu biết (người yêu thích hóa học). Dưới đây là những mục đích phổ biến:
- Tìm công thức tính số mol theo khối lượng, thể tích, nồng độ mol.
- Tìm ví dụ minh họa để áp dụng công thức vào bài tập.
- So sánh các cách tính số mol trong các điều kiện khác nhau.
- Tìm hiểu sâu hơn về các khái niệm và định nghĩa có liên quan như mol, chất khí, thể tích chuẩn, v.v.
Khái niệm về số mol là gì?
Số mol (ký hiệu: n) là lượng chất chứa 6,022 × 10²³ hạt vi mô (như nguyên tử, phân tử…). Đây là con số đặc biệt gọi là hằng số Avogadro.
“Mol chính là cây cầu nối giữa thế giới vi mô và thực tế, cho phép chúng ta tính toán, dự đoán và kiểm soát phản ứng hóa học trên quy mô phòng thí nghiệm hay công nghiệp.”
— TS. Trần Quốc Hưng, giảng viên Hóa học Đại học Sư phạm TP.HCM
Hiểu đúng khái niệm này sẽ giúp bạn tự tin giải các bài toán hóa học, lập công thức và dự đoán sản phẩm phản ứng. Bạn cũng nên tham khảo cách lập công thức hóa học của hợp chất để tăng mức độ thành thạo.
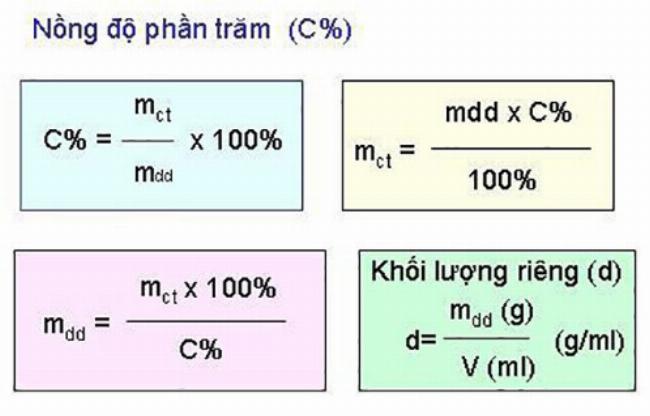
Các công thức tính số mol và cách dùng
Dưới đây là ba công thức tính số mol quan trọng nhất mà bạn cần nắm:
1. Theo khối lượng
Công thức:
n = frac{m}{M}- n: số mol (mol)
- m: khối lượng chất (g)
- M: khối lượng mol (g/mol)
Cách áp dụng:
Công thức này thường dùng cho chất rắn, lỏng khi bạn đã biết khối lượng và muốn quy đổi ra mol để phục vụ cho các phản ứng.
Ví dụ: Tính số mol của 18g nước (H₂O).
Ta có: M(H₂O) = 18 g/mol
Vậy: n = 18 / 18 = 1 mol
Để biết chính xác khối lượng mol của các nguyên tố, bạn có thể xem bảng tổng hợp tại khối lượng các nguyên tố hóa học
 Công thức tính số mol theo khối lượng dựa vào phân tử khối M
Công thức tính số mol theo khối lượng dựa vào phân tử khối M
2. Theo thể tích (chất khí ở điều kiện tiêu chuẩn)
Công thức:
n = frac{V}{22,4}- n: số mol (mol)
- V: thể tích khí (lít)
- 22,4 L/mol là thể tích mol khí ở điều kiện tiêu chuẩn (0°C, 1 atm)
Lưu ý: Công thức này chỉ áp dụng khi khí ở điều kiện tiêu chuẩn (ĐKTC). Nếu không, cần dùng phương trình khí lý tưởng.
Ví dụ:
Cho 44,8 lít khí CO₂ ở ĐKTC. Số mol khí là:
n = 44,8 / 22,4 = 2 mol
 Minh họa tính số mol chất khí ở điều kiện tiêu chuẩn
Minh họa tính số mol chất khí ở điều kiện tiêu chuẩn
3. Theo nồng độ (dung dịch)
Công thức:
n = C × V- C: nồng độ mol (mol/L)
- V: thể tích dung dịch (L)
Cách dùng:
Sử dụng khi bạn biết dung dịch có nồng độ mol C và thể tích V, từ đó suy ra số mol chất tan trong dung dịch.
Ví dụ: Một dung dịch HCl 0,5 mol/L có thể tích 0,2 L.
→ n = 0,5 × 0,2 = 0,1 mol
 Tính số mol chất tan trong dung dịch từ thể tích và nồng độ mol
Tính số mol chất tan trong dung dịch từ thể tích và nồng độ mol
Tổng hợp các công thức tính số mol
| Tình huống | Công thức tính | Ghi chú |
|---|---|---|
| Theo khối lượng | n = m / M | Dùng cho chất rắn/lỏng |
| Theo thể tích khí | n = V / 22,4 | Chỉ áp dụng ở điều kiện tiêu chuẩn |
| Theo nồng độ dung dịch | n = C × V | Thể tích lấy theo lít |
| Theo số hạt | n = N / Nₐ | N là số hạt, Nₐ = 6,022 × 10²³ (hằng số Avogadro) |
“Một học sinh vững công thức số mol sẽ tự nhiên làm chủ chuỗi bài tập từ cơ bản đến nâng cao trong suốt chương trình phổ thông.”
— Thầy Nguyễn Văn Dương, Giáo viên Hóa học THPT chuyên Lê Hồng Phong
Các thắc mắc thường gặp về công thức tính số mol
Làm sao để biết dùng công thức số mol nào?
Tùy vào dữ kiện đề bài:
- Nếu cho khối lượng → dùng n = m/M
- Nếu cho thể tích khí ở ĐKTC → dùng n = V/22,4
- Nếu cho nồng độ và thể tích dung dịch → dùng n = C × V
Khi nào phải chuyển đơn vị ml sang lít?
Tất cả công thức số mol với dung dịch đều cần thể tích đơn vị lít. 1 lít = 1000 ml, do đó cần chia cho 1000 trước khi thay vào công thức.
Có cần nhớ tất cả công thức không?
Chỉ cần hiểu bản chất, bạn sẽ tự suy luận được. Đặc biệt, chỉ có ba công thức thường dùng trong chương trình phổ thông.
Để hiểu rõ hơn về các phản ứng mà số mol được ứng dụng trực tiếp, bạn có thể thực hành với phần bài tập tại một số bài tập về phản ứng oxi hóa khử
Mở rộng: Các cách tính khác liên quan đến số mol
Dựa vào phương trình hóa học
Khi đề bài cho phương trình và yêu cầu tính toán, số mol của từng chất liên quan được tính theo tỉ lệ mol từ phương trình phản ứng.
Ví dụ: 2H₂ + O₂ → 2H₂O
Nếu có 1 mol H₂ thì phản ứng sinh ra bao nhiêu mol H₂O? → 1 mol H₂ sinh 1 mol H₂O
Kết hợp các công thức
Nhiều bài tập yêu cầu kết hợp các công thức như:
- Tính n từ m → Tính tiếp thể tích dung dịch cần pha
- Tính V khí sinh ra từ khối lượng chất rắn ban đầu
Sự linh hoạt trong vận dụng công thức là chìa khóa giải bài nhanh và đúng.
Kết luận
Hiểu và vận dụng tốt công thức tính số mol chính là bước đầu tiên quan trọng giúp bạn làm chủ Hóa học từ lớp 8 đến lớp 12. Nó không chỉ giúp tính toán mà còn là nền tảng khi học về phản ứng, cân bằng phương trình, định lượng và xác định công thức hóa học.
Hãy nhớ: Việc học hóa không dừng lại ở việc thuộc công thức, mà là hiểu được khi nào và vì sao mình dùng công thức đó.
Giờ thì bạn đã sẵn sàng thực chiến với các dạng bài mol chưa? Nếu có bất kỳ thắc mắc nào về số mol, cứ để lại bình luận – chúng tôi luôn đồng hành cùng bạn trên hành trình chinh phục thế giới hóa học!











