Trong chương trình hóa học phổ thông, bài tập về số oxi hóa luôn là phần trọng tâm xuất hiện xuyên suốt từ lớp 10 đến lớp 12. Đây không chỉ là kiến thức nền tảng giúp học sinh hiểu về phản ứng oxi hóa – khử, mà còn là bước đệm để xử lý nhiều dạng bài tập tính toán hoặc nhận biết phức tạp hơn. Trong bài viết này, chúng ta sẽ cùng tìm hiểu cách nhận diện, xác định và giải bài tập liên quan đến số oxi hóa một cách dễ hiểu, logic và chuẩn xác – phù hợp cho cả học sinh lẫn giáo viên.
Để hiểu rõ hơn về cấu trúc nguyên tử và mối liên hệ giữa các nguyên tố trong bảng tuần hoàn – kiến thức nền quan trọng khi học về số oxi hóa – bạn có thể tham khảo thêm bài viết về 2 nguyên tố thuộc 2 chu kì liên tiếp.
TÓM TẮT
- 1 Số oxi hóa là gì và tại sao nó lại quan trọng?
- 2 Cách xác định số oxi hóa đơn giản và chính xác
- 3 Các dạng bài tập về số oxi hóa thường gặp
- 4 Cách giải bài tập số oxi hóa hiệu quả trong 4 bước
- 5 Một số bài tập số oxi hóa chọn lọc thường gặp
- 6 Những lỗi phổ biến khi làm bài tập số oxi hóa
- 7 Phân biệt số oxi hóa với hóa trị: Đừng để bị đánh lừa!
- 8 Những mẹo nhỏ giúp giải bài siêu tốc
- 9 Câu hỏi thường gặp về số oxi hóa
- 10 Kết luận: “Giải” số oxi hóa – yếu tố then chốt trong hóa học phổ thông
Số oxi hóa là gì và tại sao nó lại quan trọng?
Số oxi hóa (SOH) chính là “chìa khóa” để hiểu được ai cho electron, ai nhận electron trong các phản ứng hóa học. Một cách đơn giản, số oxi hóa biểu thị mức độ “cho hay nhận” electron của một nguyên tử trong phân tử hoặc ion.
“Số oxi hóa không chỉ giúp cân bằng phản ứng oxi hóa – khử, mà còn hé lộ vai trò hóa trị của nguyên tố trong hợp chất.” – Nguyễn Thị Mai Lan, GV Hóa Trường THPT chuyên Nguyễn Huệ
Mục đích của việc dùng số oxi hóa trong bài tập
- Xác định chất khử, chất oxi hóa
- Cân bằng phản ứng oxi hóa – khử
- Dự đoán sản phẩm của phản ứng hóa học
- Làm rõ bản chất các thay đổi hoá trị trong chuỗi phản ứng
Cách xác định số oxi hóa đơn giản và chính xác
Việc đầu tiên trong mọi bài tập về số oxi hóa chính là xác định số oxi hóa của các nguyên tố. Dưới đây là những quy tắc ngắn gọn, dễ nhớ:
| Nguyên tắc | Diễn giải/nguyên lý |
|---|---|
| Nguyên tố đơn (O2, Fe, H2…) | số oxi hóa = 0 |
| Nguyên tử nhóm IA, IIA | lần lượt là +1, +2 |
| H trong hợp chất | +1 (thường), ngoại lệ: –1 khi đi với kim loại |
| O trong hợp chất | –2 (thường), ngoại lệ: –1 trong peoxit |
| Tổng số oxi hóa của phân tử trung hòa | Luôn bằng 0 |
| Tổng số oxi hóa của ion | Bằng điện tích của ion |
Ví dụ:
- H₂O: H = +1, O = –2
- Na₂SO₄: Na = +1, O = –2 ⇒ S = +6
“Chỉ cần thuộc các quy tắc cơ bản, học sinh có thể xác định được số oxi hóa cho 90% các hợp chất phổ biến trong sách giáo khoa.” – Trần Quốc Hưng, chuyên viên phát triển chương trình Hóa học THPT
Các dạng bài tập về số oxi hóa thường gặp
1. Xác định số oxi hóa của từng nguyên tố
Đây là dạng đơn giản nhưng cần sự cẩn trọng để xác định đúng vai trò và điện tích. Ví dụ:
Cho các chất: KMnO₄, Fe₂O₃, SO₂ → Xác định số oxi hóa cao nhất của Mn, Fe, S.
- KMnO₄: K = +1, O = –2 → Mn = +7
- Fe₂O₃: O = –2, tổng 3 O = –6 → 2Fe = +6 → Fe = +3
- SO₂: O = –2, tổng –4 → S = +4
2. Nhận diện quá trình oxi hóa – khử
Một phản ứng hóa học đơn thuần có thể khá khó nhận diện nếu không có kiến thức về số oxi hóa.
Ví dụ: Fe + CuSO₄ → FeSO₄ + Cu
- Fe: 0 → +2 (oxi hóa)
- Cu: +2 → 0 (khử)
→ Đây là phản ứng oxi hóa – khử. Còn nếu phản ứng không thay đổi số oxi hóa thì không được xếp vào loại này.
3. Cân bằng phương trình hóa học bằng phương pháp thay đổi số oxi hóa
Một số phản ứng đặc biệt không thể cân bằng theo phương pháp truyền thống. Lúc này, sử dụng số oxi hóa để xác định mối liên hệ giữa các chất cho-nhận electron là phương pháp tối ưu.
Ví dụ:
P + HNO₃ (đặc) → H₃PO₄ + NO₂ + H₂O
- P: 0 → +5 (oxy hóa)
- N: +5 → +4 (khử)
→ Dùng phương pháp ion – electron hoặc phương pháp thăng bằng electron theo số oxi hóa để tính hệ số chính xác.
Cách giải bài tập số oxi hóa hiệu quả trong 4 bước
- Viết hóa học phân tử đầy đủ
- Xác định số oxi hóa của từng nguyên tố
- Tìm chất oxi hóa – chất khử. Tính sự thay đổi SOH
- Cân bằng bằng phương pháp SOH hoặc ion–electron
“Quan trọng không phải bạn thuộc hết phản ứng, mà bạn hiểu bản chất của việc trao đổi electron giữa các nguyên tử.” – Nguyễn Thị Mai Lan
Một số bài tập số oxi hóa chọn lọc thường gặp
Bài 1: Tìm chất oxi hóa – chất khử
Phản ứng: 2FeCl₃ + H₂S → 2FeCl₂ + S + 2HCl
→ Fe: +3 → +2 (Bị khử)
→ S: –2 → 0 (Bị oxi hóa)
Bài 2: Cân bằng phản ứng oxi hóa – khử
Phản ứng: Cu + HNO₃ (đặc) → Cu(NO₃)₂ + NO₂ + H₂O
Bước 1: Xác định SOH Cu: 0 → +2; N: +5 → +4
Bước 2: Cu cho 2e; N nhận 1e → Phải nhân N x2
Bước 3: Cân bằng theo electron và sau đó cân bằng H, O và các phần tử còn lại
Bài 3: Tìm số oxi hóa thay đổi trong phản ứng
BaO₂ + H₂SO₄ → BaSO₄ + H₂O₂
- Ba: không thay đổi
- O trong O₂²–: từ –1 → –1 trong H₂O₂
Khác với hợp chất vô cơ thông thường, peoxit có số oxi hóa O là –1, điều này khiến nhiều bạn bối rối.
Những lỗi phổ biến khi làm bài tập số oxi hóa
- Nhầm lẫn giữa số oxi hóa và hóa trị
- Không xét đúng mức độ oxi hóa – khử (thiếu/nhầm chất oxi hóa)
- Cân bằng sai hệ số do không kiểm tra lại tổng số electron trao đổi
- Quên xét đến các hệ số trong ion đa nguyên tử (như SO₄²–, NO₃–)
“Sử dụng bảng tuần hoàn khi xác định số oxi hóa sẽ giúp bạn định hình được xu hướng cho hoặc nhận electron rõ ràng hơn.” – Trần Quốc Hưng
 Bảng quy tắc xác định số oxi hóa trong bài tập hóa học lớp 10
Bảng quy tắc xác định số oxi hóa trong bài tập hóa học lớp 10
Phân biệt số oxi hóa với hóa trị: Đừng để bị đánh lừa!
| Tiêu chí | Số oxi hóa | Hóa trị |
|---|---|---|
| Bản chất | Số biểu thị mức độ mất/gain e– | Số liên kết (hoặc khả năng liên kết) |
| Giá trị | Có thể âm, dương, hoặc không | Luôn dương |
| Biểu hiện trong ion | Thể hiện rõ trong hợp chất ion và phản ứng | Không thể hiện rõ ràng |
| Vai trò trong oxi hóa – khử | Cốt lõi | Không liên quan |
→ Ví dụ lừa đảo: Fe trong FeCl₃ có hóa trị III, nhưng số oxi hóa là +3 → tưởng giống nhưng bản chất khác!
Để kiểm tra kiến thức nền, bạn cũng nên xem lại các nguyên tố như n là nguyên tố gì, từ đó áp dụng nó vào các dạng bài số oxi hóa tương tự.
Những mẹo nhỏ giúp giải bài siêu tốc
- Nhớ thứ tự ưu tiên điền số oxi hóa: kim loại trước – phi kim sau
- Luôn xem tổng SOH trong ion/phân tử để xác định phần còn thiếu
- Dùng “bút màu” hoặc phương pháp gạch chân để theo dõi nguyên tố biến đổi
- Vẽ sơ đồ liên kết e– khi chưa chắc chắn
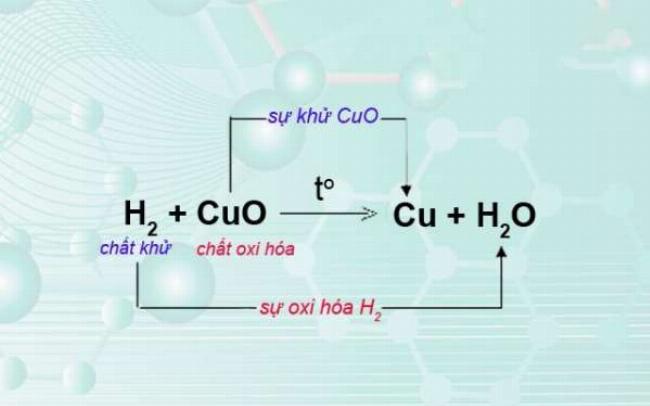 Sơ đồ giúp nhận biết sự trao đổi electron oxi hóa và khử trong hợp chất hóa học
Sơ đồ giúp nhận biết sự trao đổi electron oxi hóa và khử trong hợp chất hóa học
Câu hỏi thường gặp về số oxi hóa
Số oxi hóa và hóa trị có giống nhau không?
Không giống. Số oxi hóa liên quan đến sự chuyển dịch electron, còn hóa trị phản ánh khả năng liên kết.
Làm thế nào để biết nguyên tố nào bị oxi hóa?
Nguyên tố có số oxi hóa tăng sau phản ứng là nguyên tố bị oxi hóa (mất electron).
Số oxi hóa cao nhất của lưu huỳnh là mấy?
Lưu huỳnh có số oxi hóa cao nhất là +6 (ví dụ trong H₂SO₄).
Dấu hiệu của phản ứng oxi hóa – khử là gì?
- Có sự thay đổi số oxi hóa
- Có sự chuyển electron (trao nhận e–)
- Có sản phẩm là đơn chất hoặc điện tử trung gian (NO, NO₂…)
Kết luận: “Giải” số oxi hóa – yếu tố then chốt trong hóa học phổ thông
Bài tập về số oxi hóa là môn học tuy quen nhưng không dễ! Việc nắm chắc quy tắc và kỹ thuật giải sẽ giúp học sinh làm chủ mọi phản ứng oxi hóa – khử, mở đường để tiếp cận kiến thức hóa học sâu hơn. Hãy coi số oxi hóa như một chiếc “bản đồ”, giúp bạn điều hướng chính xác trong mê cung hóa học, từ chương trình lớp 10 đến khi vào đại học. Đừng quên áp dụng kiến thức này vào cả các phần như định luật bảo toàn khối lượng, bởi mọi sự biến đổi đều phải tuân thủ nguyên tắc nền tảng.
Nếu bạn đang bắt đầu làm quen hoặc muốn nâng cao kỹ năng làm bài, hãy luyện tập thường xuyên và đừng ngại hỏi khi gặp khó khăn – vì Hóa học không chỉ có công thức, mà còn là nghệ thuật của logic và tư duy!












