Natri (Na) là một nguyên tố hóa học có nhiều ứng dụng trong đời sống và khoa học. Đối với học sinh – sinh viên, việc hiểu rõ tính chất hóa học của Na không chỉ giúp trong việc học tập mà còn mở rộng tầm nhìn về ứng dụng thực tiễn của nó. Bài viết này sẽ cung cấp một cái nhìn bao quát về natri, từ vị trí trong bảng tuần hoàn, tính chất vật lí, tính chất hóa học của natri cho đến cách điều chế và ứng dụng. Khám phá thật kỹ về nguyên tố hóa học này cùng hoahocphothong này nhé!
Natri là gì? (Định nghĩa)
Natri là kim loại kiềm phổ biến nhất trong vỏ Trái Đất, xếp thứ sáu về độ phổ biến. Nó có mặt trong nhiều khoáng chất như felspat, sodalit và đá muối. Dưới đây là một số thông tin cơ bản:
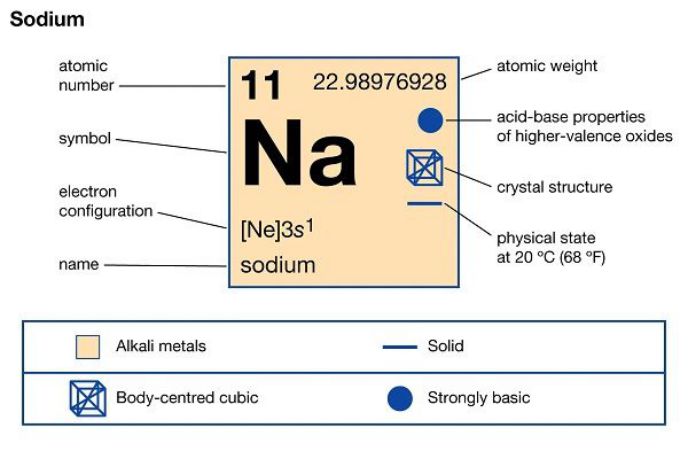
- Kí hiệu hóa học: Na
- Số hiệu nguyên tử: 11
- Khối lượng nguyên tử: 23 g/mol
- Cấu hình electron: [Ne] 3s¹
- Vị trí trong bảng tuần hoàn: Nhóm IA, Chu kì 3, Ô 11
- Độ âm điện: 0,93
- Đồng vị: Đồng vị ổn định duy nhất của natri là 23Na.
Tính chất vật lí của Natri
Natri có những tính chất vật lí đặc trưng khiến nó trở thành một kim loại kiềm thú vị:
- Là kim loại trắng-bạc, có ánh kim sáng bóng.
- Natri là kim loại rất mềm, có thể cắt bằng dao, và có khối lượng riêng rất nhỏ (0,968 g/cm³).
- Nhiệt độ nóng chảy của natri thấp, chỉ ở 97,8°C và nó sôi ở nhiệt độ 886°C.
- Một cách nhận biết natri phổ biến là đốt cháy nó. Khi đốt, natri cho ngọn lửa màu vàng đặc trưng.
Tính chất hóa học của Natri
Tính chất hóa học của kim loại Natri là tính khử mạnh, và khi tham gia các phản ứng hóa học, nó thường mất 1 electron để tạo ion Na⁺. Dưới đây là các tính chất hóa học nổi bật của natri:
Tác dụng với phi kim
Natri phản ứng mạnh với các phi kim, đặc biệt là oxi và clo. Khi đốt trong không khí hoặc trong oxi, natri cháy tạo ra các oxit và peroxit.
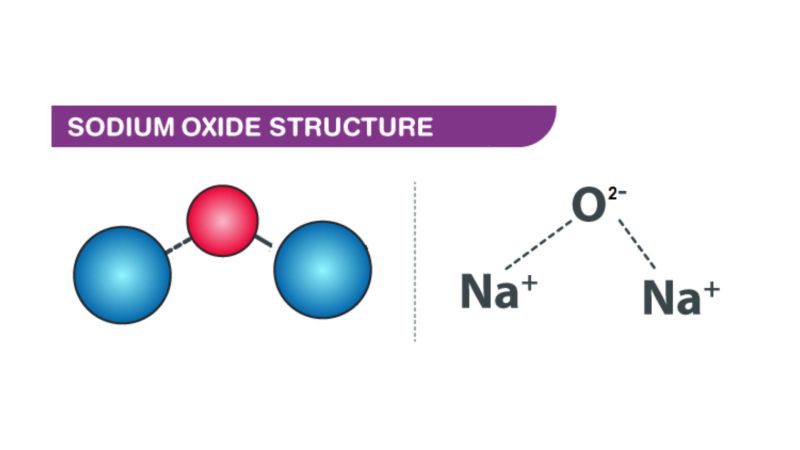
- Phản ứng với oxi:
- 4Na + O₂ → 2Na₂O
(Natri oxit) - Phản ứng với clo:
2Na + Cl₂ → 2NaCl
(Natri clorua)
Tác dụng với axit
Natri dễ dàng phản ứng với axit loãng như HCl hoặc H₂SO₄, khử ion H⁺ thành khí hidro.
- Ví dụ với HCl:
2Na + 2HCl → 2NaCl + H₂
(Natri clorua và khí hidro)
Tác dụng với nước
Natri phản ứng mãnh liệt với nước, tạo ra dung dịch kiềm natri hiđroxit (NaOH) và giải phóng khí hidro.
- Phản ứng với nước:
2Na + 2H₂O → 2NaOH + H₂
(Natri hiđroxit và khí hidro)
Tác dụng với hidro
Natri phản ứng với hidro ở nhiệt độ cao (350-400°C) và áp suất lớn, tạo ra natri hidrua (NaH).
- Phản ứng với hidro:
2Na + H₂ → 2NaH
(Natri hidrua)
Trạng thái tự nhiên của Natri
Natri không tồn tại ở dạng tự do trong tự nhiên do tính hoạt động mạnh của nó. Thay vào đó, nó tồn tại trong các hợp chất như natri clorua (muối ăn). Ở vỏ Trái Đất, natri chiếm khoảng 2,6% theo khối lượng, đứng thứ 8 về độ phổ biến.
Cách điều chế Natri
Natri được điều chế bằng phương pháp điện phân các muối nóng chảy. Quá trình này được thực hiện trong các lò điện phân, chẳng hạn như điện phân natri clorua (NaCl).
- Phản ứng điện phân NaCl:
2NaCl → 2Na + Cl₂↑
(Natri kim loại và khí clo)
Ứng dụng của Natri
Natri và các hợp chất của nó có rất nhiều ứng dụng trong công nghiệp và đời sống. Một số ứng dụng tiêu biểu gồm:
- Sản xuất este và các hợp chất hữu cơ.
- Thành phần chính trong muối ăn (NaCl), chất quan trọng cho sự sống.
- Sử dụng trong hợp kim để cải thiện tính chất vật liệu.
- Là thành phần trong xà phòng (phản ứng với axít béo).
- Sử dụng trong đèn hơi natri, loại đèn hiệu quả trong việc chuyển hóa điện năng thành ánh sáng.
- Dùng như chất dẫn nhiệt trong lò phản ứng hạt nhân.
Các hợp chất quan trọng của Natri
- Natri hidroxit (NaOH): Chất ăn mòn mạnh, dùng trong sản xuất xà phòng, giấy, và xử lý nước.
- Natri hiđrocacbonat (NaHCO₃): Baking soda, dùng trong chế biến thực phẩm và các phản ứng hóa học.
- Natri cacbonat (Na₂CO₃): Sô đa, dùng trong sản xuất thủy tinh và các quy trình công nghiệp.
Khám phá ngay chuyên mục “Tài liệu hóa học phổ thông” để nắm vững kiến thức từ cơ bản đến nâng cao!
Bài tập vận dụng
Bài tập 1: Nhận biết 3 chất NaOH, Ba(OH)₂, NaCl bằng phương pháp hóa học và viết các phương trình hóa học tương ứng.
Hướng dẫn giải:
- Lấy mẫu thử từ mỗi lọ và hòa tan vào nước để tạo dung dịch.
- Dùng quỳ tím để nhận biết dung dịch nào là bazơ:
- Lọ chứa NaOH và Ba(OH)₂ đều làm quỳ tím chuyển màu xanh (do đây là các bazơ mạnh).
- Lọ chứa NaCl không làm đổi màu quỳ tím, vì NaCl là muối trung tính.
- Cho H₂SO₄ loãng vào 2 dung dịch làm quỳ tím chuyển xanh:
- Lọ nào tạo ra kết tủa trắng là dung dịch Ba(OH)₂. Phản ứng giữa Ba²⁺ và SO₄²⁻ tạo kết tủa BaSO₄ trắng không tan: Ba(OH)2+H2SO4→BaSO4(rắn)+2H2O
- Dung dịch còn lại không tạo kết tủa là NaOH.
Vậy thứ tự các chất trong các lọ là: NaCl, Ba(OH)₂, NaOH.
Lời kết
Bài viết này hy vọng giúp các bạn học sinh – sinh viên có cái nhìn sâu hơn về natri, từ tính chất, cách nhận biết đến ứng dụng trong thực tiễn. Từ những kiến thức này, các bạn có thể hiểu rõ hơn về tầm quan trọng của natri trong hóa học và đời sống hàng ngày.
Có thể bạn quan tâm:
- Tính chất hóa học của Canxi – Nguyên Tố Thiết Yếu Cho Sự Sống Và Những Ứng Dụng
- Tính chất hóa học của Đồng (Cu) Kim Loại Của Sự Dẻo Dai
- Tính Chất Hóa Học của Bạc (Ag) & Ứng dụng đời sống