Khí lưu huỳnh đioxit (SO2) không chỉ là một hợp chất hóa học thú vị mà còn đóng vai trò quan trọng trong nhiều lĩnh vực của cuộc sống. Vậy SO2 là gì? Nó được hình thành ra sao? Những ứng dụng và tác hại của nó trong đời sống hàng ngày là gì, tính chất hóa học của so2? Hãy cùng Hoahocphothong khám phá tất cả những thông tin thú vị này trong bài viết dưới đây.
TÓM TẮT
Lưu Huỳnh Đioxit Là Gì?
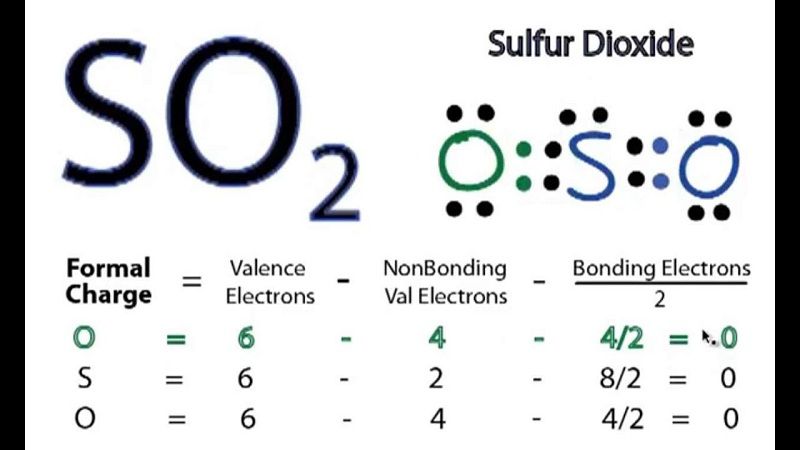
Lưu huỳnh đioxit, còn được biết đến với tên gọi anhiđrit sunfurơ, là một hợp chất hóa học có công thức phân tử là SO2. Đây là một khí vô cơ không màu, có mùi hắc và nặng hơn không khí. Lưu huỳnh đioxit là sản phẩm chính của quá trình đốt cháy hợp chất chứa lưu huỳnh.
Các Tên Gọi Khác
- Sulfur Dioxit
- Lưu Huỳnh Oxit
- Khí SO2
Nguồn Gốc Hình Thành Khí SO2
Trong Tự Nhiên
Khí SO2 được sinh ra từ nhiều nguồn tự nhiên, chẳng hạn như:
Vụ núi lửa phun trào: Khi núi lửa hoạt động, khí lưu huỳnh có trong lòng đất được phun ra ngoài, tạo thành SO2.
Phân hủy sinh học: Các hợp chất chứa lưu huỳnh trong sinh vật khi phân hủy cũng tạo ra khí SO2.
Nhân Tạo
Khói thải từ các nhà máy: Các ngành công nghiệp như lọc dầu, luyện kim, sản xuất xi măng và giấy đều thải ra khí SO2 trong quá trình sản xuất.
Phương tiện giao thông: Khí thải từ ô tô, xe máy cũng góp phần không nhỏ vào sự gia tăng nồng độ SO2 trong không khí.
Hoạt động sinh hoạt: Khói thuốc lá, thiết bị sử dụng gas kém chất lượng và các hoạt động đốt rác cũng tạo ra khí SO2.
Tính Chất Vật Lý Của SO2
Mùi Vị
SO2 có mùi hắc, khó chịu, thường được mô tả là mùi của diêm.
Tính Chất Khác
- Tình trạng: Là một khí không màu.
- Khối lượng riêng: 2,551 g/l (nặng hơn không khí).
- Điểm nóng chảy: -72,4 °C.
- Điểm sôi: -10 °C.
- Độ hòa tan: SO2 có độ hòa tan cao trong nước, khoảng 9,4 g/100ml ở 25 °C.
Tính Chất Hóa Học Của SO2
Khí lưu huỳnh đioxit thể hiện nhiều tính chất hóa học của oxit đặc trưng:
Oxy hóa: SO2 có khả năng oxy hóa chậm trong không khí, dễ dàng chuyển thành SO3 dưới tác động của chất xúc tác hoặc ánh sáng mặt trời.
Phản ứng:
SO2 + O2 → SO3
Tác dụng với nước: Khi hòa tan trong nước, SO2 tạo thành axit sunfurơ (H2SO3), một axit yếu.
Phản ứng:
SO2 + H2O → H2SO3
Phản ứng với kiềm: SO2 có thể phản ứng với dung dịch kiềm để tạo ra muối sunfit hoặc hidrosunfit.
Phản ứng:
SO2 + 2NaOH → Na2SO3 + H2O
SO2 + NaOH → NaHSO3
Chất oxy hóa và khử: SO2 có thể đóng vai trò là chất khử khi phản ứng với các chất oxy hóa mạnh.
Ví dụ:
2SO2 + O2 → 2SO3
Phản ứng với nước Brom: Khi cho SO2 vào dung dịch nước brom, nó sẽ làm mất màu dung dịch.
Phản ứng:
SO2 + Br2 + 2H2O → 2HBr + H2SO4

Điều Chế Lưu Huỳnh Đioxit
Trong Phòng Thí Nghiệm
Khí SO2 có thể được điều chế từ phản ứng giữa natri sunfit (Na2SO3) và axit sunfuric (H2SO4).
Phản ứng:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
Trong Công Nghiệp
Đốt lưu huỳnh:
S + O2 → SO2
Đốt H2S trong oxy:
2H2S + 3O2 → 2H2O + 2SO2
Cho kim loại phản ứng với H2SO4:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Ứng Dụng Của Lưu Huỳnh Đioxit
Lưu huỳnh đioxit có nhiều ứng dụng trong cuộc sống và sản xuất:
Sản xuất axit sunfuric: SO2 là nguyên liệu chính trong quá trình sản xuất axit sunfuric, một trong những hóa chất quan trọng nhất trong ngành công nghiệp.
Chất tẩy trắng: SO2 được sử dụng để tẩy trắng bột giấy và dung dịch đường, giúp loại bỏ màu sắc không mong muốn và tạo ra sản phẩm trắng sáng hơn.
Chất bảo quản thực phẩm: Trong ngành thực phẩm, SO2 được dùng để bảo quản hoa quả sấy khô, giúp ngăn chặn sự phát triển của vi khuẩn và giữ cho thực phẩm không bị hư hỏng.
Sản xuất rượu: SO2 cũng được sử dụng trong sản xuất rượu, với nồng độ rất thấp để bảo quản và giữ hương vị cho rượu.
Thuốc thử trong phòng thí nghiệm: Khí SO2 được dùng làm thuốc thử để nhận biết và phân tích nhiều chất hóa học khác.
Khám phá ngay chuyên mục “Tài liệu Hóa Học Phổ Thông” để nắm vững kiến thức từ cơ bản đến nâng cao!

Tác Hại Của SO2
Mặc dù SO2 có nhiều ứng dụng hữu ích, nhưng nó cũng có thể gây hại cho môi trường và sức khỏe con người:
Ô nhiễm môi trường: SO2 là một trong những nguyên nhân chính gây ô nhiễm không khí. Khi khí này bị oxy hóa và kết hợp với nước, nó tạo ra axit sunfuric, dẫn đến hiện tượng mưa axit gây hại cho thực vật.
Tác động đến sức khỏe: Khi hít phải SO2, khí này có thể gây ra các vấn đề về hô hấp, đặc biệt là ở những người mắc bệnh hen suyễn. Ngoài ra, SO2 còn có thể gây ra các triệu chứng như khó thở, đau mắt và kích ứng da.
Lưu Ý Khi Sử Dụng Lưu Huỳnh Đioxit
Khi tiếp xúc với khí SO2, cần lưu ý các biện pháp an toàn như:
Sử dụng trang phục bảo hộ lao động: Để tránh tiếp xúc trực tiếp với khí SO2, nên đeo khẩu trang và mặt nạ chống độc.
Sử dụng dung dịch hấp thụ: Các dung dịch như sữa vôi hay dung dịch soda có thể được dùng để hấp thụ khí SO2, giảm thiểu tác động xấu đến sức khỏe.
Trên đây là những thông tin tổng quan về khí lưu huỳnh đioxit (SO2), từ tính chất, điều chế đến ứng dụng và tác hại của nó. Hy vọng bài viết sẽ cung cấp cho bạn những kiến thức bổ ích và giúp bạn hiểu rõ hơn về hợp chất này trong cuộc sống hàng ngày. Nếu bạn có thêm câu hỏi hay thắc mắc, hãy liên hệ với chúng tôi để được tư vấn chi tiết hơn!
Có thể bạn quan tâm:











