Khi nhắc đến Silic, nhiều bạn học sinh – sinh viên có thể sẽ thấy băn khoăn không biết Silic là gì và tại sao nguyên tố này lại quan trọng trong nhiều lĩnh vực khác nhau. Nếu bạn cũng đang có thắc mắc như vậy, hãy cùng khám phá bài viết chi tiết dưới đây cùng hoahocphothong nhé. Chúng tôi sẽ cung cấp đầy đủ thông tin từ khái niệm đến tính chất hóa học của silic và ứng dụng của Silic, giúp bạn có cái nhìn tổng quan nhất về nguyên tố hóa học đặc biệt này.
TÓM TẮT
Silic là gì?
Silic (ký hiệu hóa học là Si) là một nguyên tố nằm trong bảng tuần hoàn với số hiệu nguyên tử là 14. Đây là nguyên tố phổ biến thứ hai trên Trái Đất, chỉ sau oxy, và chiếm khoảng 27,7% khối lượng vỏ Trái Đất. Silic thường xuất hiện dưới dạng một chất rắn rất cứng, màu xám sẫm, có ánh xanh kim loại. Đặc tính nổi bật của Silic là tính á kim với hóa trị +4.

Trong tự nhiên, Silic không chỉ tồn tại ở dạng tinh thể mà còn dưới dạng các hợp chất khác như cát (SiO2), cao lanh hay serpentin. Trong cơ thể sống, Silic đóng vai trò quan trọng trong hệ vi sinh, đặc biệt là việc hỗ trợ hoạt động của các vi sinh vật trong hệ tiêu hóa. Ngoài ra, Silic còn góp phần gián tiếp trong việc ngăn ngừa các bệnh về thần kinh như Alzheimer.
Tính chất hóa học của silic – Vật lý
Silic tồn tại dưới hai dạng chính:
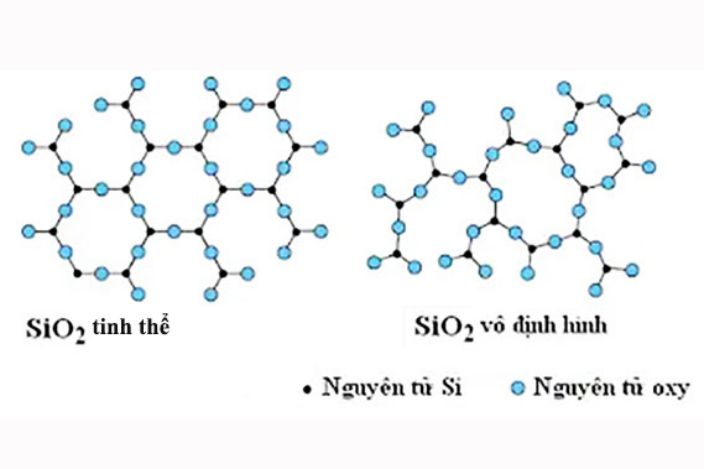
Silic vô định hình: Là chất bột màu nâu, không tan trong nước nhưng có thể tan trong kim loại nóng chảy. Dạng Silic này nổi bật với các đặc tính như bán dẫn, kháng ăn mòn và chịu được các điều kiện khắc nghiệt. Đây là một vật liệu được sử dụng rộng rãi trong nhiều ngành công nghiệp hiện đại, đặc biệt là trong sản xuất thiết bị điện tử.
Silic tinh thể: Có cấu trúc tương tự kim cương, màu xám và ánh kim. Nó nóng chảy ở 1420 độ C và ở nhiệt độ thường, khả năng dẫn điện của Silic tinh thể khá thấp. Với tính chất bán dẫn đặc biệt, Silic tinh thể là một thành phần quan trọng trong ngành công nghiệp vi mạch và điện tử.
Tính chất hóa học của Silic
Silic là một nguyên tố lưỡng tính, tức là nó vừa thể hiện tính chất hóa học của phi kim là tính khử, vừa có khả năng tính oxi hóa trong các phản ứng hóa học. Silic có các số oxi hóa phổ biến là -4, 0, +2, và +4, trong đó số oxi hóa +4 là đặc trưng nhất.
Tính khử của Silic
Tính khử của Silic thể hiện qua khả năng phản ứng với phi kim, kim loại và dung dịch kiềm:
Tác dụng với oxy:
Si + 2O2 → SiO2 (Phản ứng xảy ra ở nhiệt độ từ 400-600°C).
Đây là phản ứng phổ biến, tạo thành silic dioxit (SiO2), một hợp chất quan trọng trong tự nhiên.
Tác dụng với Flo:
Si + 2F2 → SiF4 (Phản ứng xảy ra ở nhiệt độ thường).
Silic dễ dàng phản ứng với Flo tạo thành Silic tetrafluoride (SiF4).
Tác dụng với dung dịch kiềm:
Si + 2NaOH + H2O → Na2SiO3 + 2H2.
Phản ứng này tạo ra Natri silicat (Na2SiO3), một hợp chất quan trọng trong sản xuất thủy tinh và chất tẩy rửa.
Tác dụng với axit:
4HNO3 + 18HF + 3Si → 3H2SiF6 + 4NO + 8H2O.
Phản ứng của Silic với axit mạnh như HNO3 và HF tạo ra axit hexafluorosilicic (H2SiF6), một chất có ứng dụng rộng rãi trong công nghiệp.
Tác dụng với hydro trong hồ quang điện:
Si + H2 → SiH4 + Si2H6 + Si3H6 + …
Silic có thể tạo thành các hydrua Silan (SiH4), thường được sử dụng trong công nghiệp điện tử.
Tính oxi hóa của Silic
Silic có thể phản ứng với nhiều kim loại ở nhiệt độ cao để tạo ra silixua kim loại:
Tác dụng với magie:
2Mg + Si → Mg2Si.
Phản ứng này tạo thành hợp chất Magie silixua (Mg2Si), một hợp chất quan trọng trong luyện kim.
Dù Silic có tính chất tương tự như Cacbon (C), nhưng khả năng khử của nó kém hơn. Silic không thể oxi hóa H2 như C, nhưng có thể khử một số chất oxi hóa mạnh như axit HNO3 hay H2SO4 đặc nóng.
Phương pháp điều chế Silic
Silic không tồn tại dưới dạng tự do trong tự nhiên, vì vậy cần sử dụng các phương pháp đặc biệt để điều chế nguyên tố này. Các phương pháp phổ biến bao gồm việc sử dụng chất khử mạnh để khử Silic dioxit (SiO2).
Dùng magie hoặc nhôm để khử SiO2:
SiO2 + 2Mg → 2MgO + Si.
Đây là phản ứng khử SiO2 bằng magie ở nhiệt độ cao, tạo thành Silic tinh khiết và magie oxit (MgO).
Dùng than cốc (cacbon) để khử SiO2:
SiO2 + C → 2CO + Si (Phản ứng xảy ra ở nhiệt độ khoảng 1800°C).
Phản ứng này là phương pháp sản xuất Silic quy mô công nghiệp, tạo ra Silic từ than cốc và Silic dioxit.
Thuộc tính của Silic
Silic trong dạng tinh thể là một nguyên tố tương đối trơ, tuy nhiên, nó vẫn có khả năng phản ứng với các halogen và dung dịch kiềm loãng. Điều đặc biệt là Silic có khả năng truyền 95% các bước sóng hồng ngoại, do đó nó thường được sử dụng trong các thiết bị quang học. Tinh thể Silic nguyên chất rất hiếm gặp trong tự nhiên, nhưng chúng ta có thể tìm thấy chúng trong dung nham núi lửa hoặc trong các tạp chất của vàng.
Khám phá ngay chuyên mục “Tài liệu hóa học phổ thông” để nắm vững kiến thức từ cơ bản đến nâng cao!

Ứng dụng của Silic trong đời sống
Silic là một trong những nguyên tố quan trọng nhất trong nhiều lĩnh vực của cuộc sống hiện đại. Từ xây dựng, công nghiệp cho đến y tế, Silic đóng vai trò then chốt trong việc cải thiện chất lượng sản phẩm và phát triển công nghệ.
Ứng dụng trong xây dựng
Silic là thành phần quan trọng trong sản xuất thép, gạch, xi măng và bê tông. Silic giúp gia tăng độ bền và khả năng chịu lực của các vật liệu này, góp phần tạo ra các công trình xây dựng bền vững và an toàn.
Ứng dụng trong công nghiệp
Sản xuất đồng thau: Silic được sử dụng làm hợp kim trong quá trình sản xuất đồng thau.
Gốm sứ: Đây là một thành phần không thể thiếu trong sản xuất men gốm sứ và các vật liệu chịu lửa.
Sản xuất thủy tinh: Silic là nguyên liệu chính để sản xuất thủy tinh và nhiều sản phẩm khác như kính cửa sổ, chai lọ, và các sản phẩm sứ cách điện.
Năng lượng mặt trời: Silic được sử dụng để sản xuất các tấm pin năng lượng mặt trời.
Ngành điện tử: Silic là thành phần chính trong việc sản xuất vi mạch, chip, và các thiết bị cảm biến, góp phần tạo nên sự bùng nổ của ngành công nghiệp điện tử.
Ứng dụng trong y tế
Trong y học, Silic được sử dụng trong việc chế tạo thuốc kháng sinh, thuốc chống ung thư, và băng dính y tế. Ngoài ra, Silic cũng đóng vai trò trong quá trình sản xuất các chất lọc nước và thuốc diệt côn trùng.
Dù Silic có nhiều ứng dụng quan trọng, nhưng việc sử dụng và xử lý Silic cần thận trọng để tránh tác động tiêu cực đến sức khỏe và môi trường. Các sản phẩm chứa Silic cần được sản xuất và sử dụng đúng quy trình để bảo đảm an toàn.
Kết luận
Silic là một nguyên tố hóa học quan trọng với nhiều ứng dụng trong đời sống và công nghiệp. Hiểu rõ về Tính chất hóa học của silic & vật lý, cũng như vai trò của Silic giúp chúng ta biết cách sử dụng nguyên tố này hiệu quả và bền vững, đảm bảo sức khỏe và bảo vệ môi trường.
Có thể bạn quan tâm: