Nitơ là một nguyên tố hóa học vô cùng quan trọng, không chỉ trong phòng thí nghiệm mà còn trong nhiều lĩnh vực đời sống và công nghiệp. Bài viết này sẽ cung cấp cho bạn cái nhìn toàn diện về nitơ, từ khái niệm, cấu tạo phân tử đến tính chất vật lý, tính chất hóa học của nitơ, cũng như ứng dụng phổ biến của nó. Bằng cách tiếp cận kiến thức này, học sinh – sinh viên sẽ hiểu rõ hơn về tầm quan trọng của nitơ và cách thức mà nguyên tố này tác động đến cuộc sống hàng ngày của chúng ta. Khám phá ngay cùng hoahocphothong nhé!
TÓM TẮT
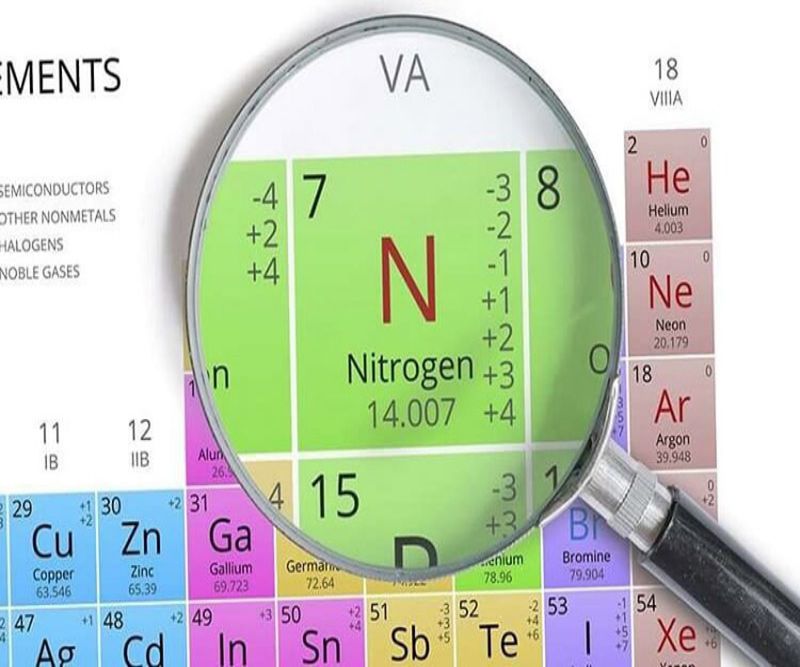
Khái Niệm Về Nitơ
Nitơ (N2) là thành phần chính của khí quyển Trái Đất, chiếm khoảng 78% tổng lượng khí trong không khí. Nitơ đóng vai trò bảo vệ Trái Đất khỏi tác động của bức xạ mặt trời và giúp duy trì sự sống. Nó tồn tại chủ yếu ở hai dạng: nitơ khí và nitơ lỏng. Trong đó, nitơ lỏng được sử dụng phổ biến hơn trong đời sống hàng ngày do những tính chất vật lý đặc biệt của nó.

Cấu tạo phân tử của nitơ (N2):
- Nitơ thuộc nhóm VA trong bảng tuần hoàn, với cấu hình electron ngoài cùng là ns2np3ns^2np^3ns2np3, nên nó có cả tính oxi hóa và tính khử.
- Cấu hình electron đầy đủ của nitơ là 1s22s22p31s^2 2s^2 2p^31s22s22p3, và các trạng thái oxi hóa có thể dao động từ -3, 0, +1, +2, +3, +4 đến +5.
Tính chất hóa học của nitơ – tính chất vật lý
Tính Chất Vật Lý
Nitơ là một chất khí không màu, không mùi, không vị và nhẹ hơn không khí. Tỷ trọng của nó là d=2829d = \frac{28}{29}d=2928, hóa lỏng ở nhiệt độ -196°C. Nitơ ít tan trong nước và không duy trì sự cháy cũng như hô hấp, điều này làm cho nó trở nên rất an toàn khi sử dụng trong các ứng dụng bảo quản và công nghiệp.
Tính Chất Hóa Học
Tính chất hóa học của phi kim Nitơ: có năng lượng liên kết rất cao (946 kJ/mol), khiến nó trở nên khá trơ ở nhiệt độ thường. Tuy nhiên, khi ở nhiệt độ cao, nitơ có thể phản ứng mạnh mẽ với các chất khác.
Tính oxi hóa của nitơ:
Phản ứng với hiđro (H2): Ở nhiệt độ và áp suất cao, với sự có mặt của chất xúc tác, nitơ phản ứng với hiđro để tạo thành amoniac:
N2+3H2→2NH3
Phản ứng với kim loại: Ở nhiệt độ thường, nitơ phản ứng với liti (Li) tạo ra liti nitrua:
6Li+N2→2Li3N
Ở nhiệt độ cao, nitơ tác dụng với magiê (Mg) để tạo ra magiê nitrua:
3Mg+N2→Mg3N2
Tính khử của nitơ:
- Phản ứng với oxi (O2): Ở nhiệt độ rất cao (khoảng 3000°C), nitơ có thể tác dụng với oxi để tạo ra nitơ monoxit (NO): N2+O2→2NO
Sau đó, nitơ monoxit phản ứng với oxi trong không khí tạo ra nitơ dioxit (NO2) đặc trưng bởi màu nâu đỏ: 2NO+O2→2NO
Ngoài ra, nitơ còn có thể tồn tại ở nhiều dạng oxit khác nhau như N2O, N2O3, N2O5, nhưng những oxit này không được điều chế trực tiếp từ phản ứng giữa nitơ và oxi.

Trạng Thái Tự Nhiên Của Nitơ
Nitơ tồn tại trong tự nhiên ở hai dạng chính: tự do và hợp chất. Trong khí quyển, nitơ chiếm khoảng 80% thể tích không khí. Dưới dạng hợp chất, nitơ là thành phần của protein, axit nucleic và nhiều hợp chất khác trong sinh vật. Người ta tìm thấy nitơ trong một số khoáng vật như natri nitrat (NaNO3), hay còn được gọi là diêm tiêu natri.
Các Ứng Dụng Của Nitơ
Nitơ đóng vai trò quan trọng trong nhiều lĩnh vực, từ đời sống hàng ngày đến các ngành công nghiệp hiện đại.
Bảo Quản Thực Phẩm
Vì nitơ không phản ứng với các chất khác ở điều kiện thường, nó được sử dụng rộng rãi trong việc bảo quản thực phẩm. Nitơ giúp ngăn chặn sự oxi hóa, làm chậm quá trình ôi thiu và bảo vệ thực phẩm khỏi tác động của không khí.
Hàn Ống Và Chế Biến Kim Loại
Nitơ được sử dụng để hàn ống và chế biến kim loại, giúp nâng cao độ bền của các sản phẩm. Trong quá trình này, nitơ làm sạch các đường ống, bảo vệ các kim loại khỏi sự ăn mòn và đảm bảo an toàn.
Luyện Kim Và Sản Xuất Thép Không Gỉ
Trong ngành luyện kim, nitơ giúp sản xuất các linh kiện điện tử và thép không gỉ. Tùy thuộc vào đặc thù công việc và yêu cầu kỹ thuật, lượng nitơ sử dụng có thể thay đổi.
Bơm Lốp Xe Ô Tô Và Máy Bay
Nitơ được sử dụng để bơm lốp xe ô tô và máy bay nhờ vào tính chất trơ, không chứa độ ẩm và khả năng chống oxi hóa cao.
Vận Chuyển Thực Phẩm Và Mẫu Sinh Học
Nitơ lỏng thường được sử dụng để làm lạnh trong quá trình vận chuyển thực phẩm hoặc bảo quản các mẫu sinh học như tế bào, trứng và tinh trùng.
Nghiên Cứu Và Giáo Dục
Trong phòng thí nghiệm, nitơ được dùng để phân tích mẫu và là thành phần trong nhiều hợp chất hóa học. Nó cũng đóng vai trò quan trọng trong việc giảng dạy các kiến thức hóa học liên quan đến nguyên tố này.
Khám phá ngay chuyên mục “Tài liệu hóa học phổ thông” để nắm vững kiến thức từ cơ bản đến nâng cao!
Điều Chế Nitơ
Nitơ có thể được điều chế bằng nhiều phương pháp khác nhau, phụ thuộc vào mục đích sử dụng.
Trong phòng thí nghiệm:
- Người ta thường sử dụng amoni clorua (NH4Cl) và natri nitrit (NaNO2) để điều chế khí nitơ.
- Đun nóng amoni dicromat hoặc phân hủy nhiệt natri azide.
Trong công nghiệp:
- Phương pháp chưng cất phân đoạn không khí lỏng là cách phổ biến nhất để điều chế nitơ tinh khiết, hoặc sử dụng các màng lọc cơ học và áp suất.
Lời kết
Bài viết trên đã cung cấp một cái nhìn tổng quát về nitơ, từ cấu tạo phân tử, tính chất hóa học của nitơ, trạng thái tự nhiên đến các ứng dụng và phương pháp điều chế. Nitơ không chỉ là một nguyên tố quan trọng trong khí quyển mà còn có nhiều ứng dụng trong công nghiệp và đời sống hàng ngày, mang lại nhiều lợi ích thiết thực cho xã hội.
Có thể bạn quan tâm:













