Tính chất hóa học của muối cơ bản và phổ biến, đóng vai trò quan trọng trong nhiều lĩnh vực của cuộc sống và nghiên cứu khoa học. Tuy nhiên, để hiểu rõ hơn về muối cũng như ứng dụng của chúng trong thực tế, ta cần khám phá sâu hơn về cấu trúc và tính chất hóa học của hợp chất này. Bài viết dưới đây, hoahocphothong sẽ cung cấp cho bạn cái nhìn tổng quan cũng như những kiến thức cần thiết về muối, đồng thời đưa ra các ví dụ cụ thể để bạn có thể nắm vững hơn về chủ đề này.
TÓM TẮT
Khái Niệm Về Muối
Tính chất hóa học của muối: Theo định nghĩa hóa học, muối là một hợp chất được tạo thành từ sự kết hợp của các ion dương (cation) và ion âm (anion), sao cho tổng điện tích của các ion này là bằng không, tức là trung hòa điện tích. Muối có thể tồn tại dưới nhiều dạng khác nhau, bao gồm muối hữu cơ và vô cơ, với các cấu trúc phân tử đa dạng từ đơn nguyên tử đến đa nguyên tử. Điều này giúp muối có thể tồn tại trong nhiều trạng thái vật lý và hóa học khác nhau.
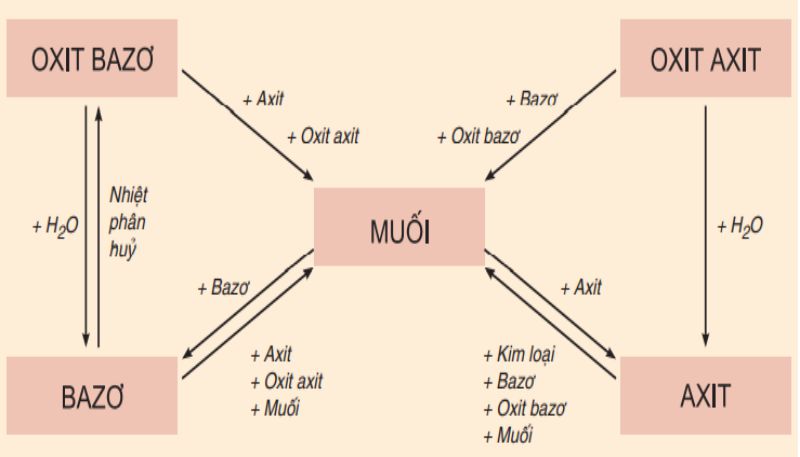
Thành phần của muối thường bao gồm các cation kim loại (hoặc cation amonium NH4+) kết hợp với các gốc axit. Công thức chung của muối có thể được viết là: Tên kim loại (hoặc cation) + Tên gốc axit. Trong một số trường hợp, khi kim loại có nhiều hóa trị khác nhau, cần chỉ rõ hóa trị của kim loại đó trong tên của muối.
Phân Loại Muối
Muối có thể được phân chia thành hai nhóm chính dựa trên cấu trúc hóa học của chúng:
Muối trung hòa: Là loại muối mà trong cấu trúc không chứa nguyên tử hydro có khả năng thay thế bằng kim loại. Ví dụ như muối natri cacbonat (Na2CO3) hoặc canxi cacbonat (CaCO3). Đây là những hợp chất rất phổ biến và thường được sử dụng trong đời sống hàng ngày.
Muối axit: Là loại muối mà trong cấu trúc vẫn còn nguyên tử hydro thuộc gốc axit, không thể thay thế bằng kim loại. Ví dụ điển hình như natri bisunfat (NaHSO4) hoặc kali dihidrophotphat (K2HPO4). Những muối này có tính axit nhẹ và có thể phản ứng với kiềm để tạo ra muối trung hòa.
Tính Chất Hóa Học Của Muối
Muối là hợp chất có nhiều tính chất hóa học đặc trưng, chúng có thể tham gia vào nhiều phản ứng hóa học khác nhau. Dưới đây là một số tính chất hóa học của muối mà chúng ta thường gặp:
Phản ứng đổi màu quỳ tím
Muối có thể làm thay đổi màu sắc của quỳ tím, tùy thuộc vào tính axit hoặc bazo của nó. Nếu muối có tính axit mạnh, quỳ tím sẽ chuyển sang màu đỏ, trong khi muối có tính bazo mạnh sẽ làm quỳ tím chuyển màu xanh. Đối với các muối trung tính, quỳ tím sẽ không thay đổi màu sắc.
Phản ứng với kim loại
Muối có khả năng phản ứng với một số kim loại để tạo ra muối mới và kim loại mới. Điều này thường xảy ra khi kim loại tham gia phản ứng có tính khử mạnh hơn kim loại có trong muối ban đầu. Ví dụ như:
Fe + CuSO4 → FeSO4 + Cu
Trong phản ứng này, sắt (Fe) đẩy đồng (Cu) ra khỏi dung dịch, tạo thành muối sắt sunfat (FeSO4) và kim loại đồng.
Phản ứng với axit
Muối có thể phản ứng với axit để tạo ra muối mới và axit mới. Ví dụ như phản ứng giữa bạc nitrat (AgNO3) và axit clohidric (HCl) tạo ra bạc clorua (AgCl) và axit nitric (HNO3):
HCl + 2AgNO3 → AgCl + HNO3
Trong phản ứng này, bạc clorua là một chất không tan và dễ dàng tách ra khỏi dung dịch dưới dạng kết tủa.
Cùng chủ đề:
- Tính chất hóa học của muối Cacbonat – Tính Chất và Ứng Dụng Trong Đời Sống
- Tính chất hóa học của muối Amoni – Tính Chất Và Ứng Dụng Trong Đời Sống
- Kiến thức tổng hợp tính chất hóa học của Sunfua đến ứng dụng trong cuộc sống
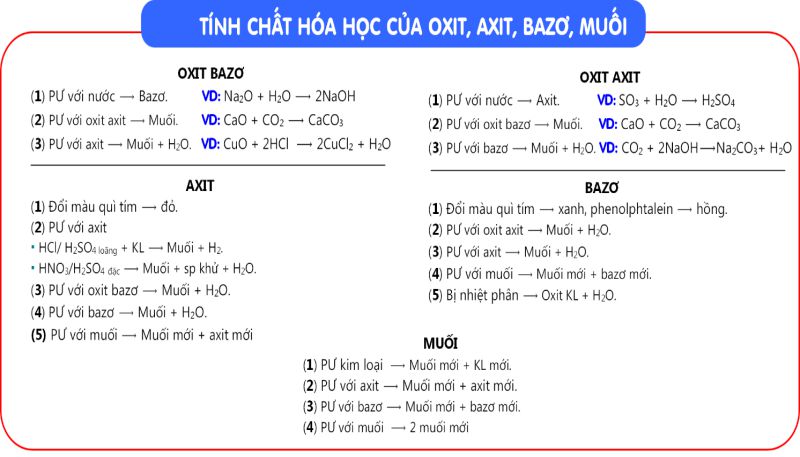
Phản ứng với bazo
Muối có khả năng phản ứng với bazo để tạo thành muối mới và hydroxit kim loại. Điều này thường xảy ra khi sau phản ứng tạo ra một sản phẩm không tan. Ví dụ:
CuCl2 + 2KOH → Cu(OH)2 + 2KCl
Trong phản ứng này, đồng (II) hydroxit (Cu(OH)2) là chất kết tủa không tan, và được hình thành sau phản ứng.
Phản ứng giữa hai muối
Hai muối có thể phản ứng với nhau để tạo thành hai muối mới, với điều kiện rằng ít nhất một trong hai sản phẩm là chất kết tủa không tan hoặc dễ bay hơi. Ví dụ:
NaCl + AgNO3 → NaNO3 + AgCl
Trong phản ứng này, bạc clorua (AgCl) là chất không tan và tạo thành kết tủa.
Phản ứng nhiệt phân
Một số muối có thể bị nhiệt phân khi ở nhiệt độ cao, phân hủy thành các chất đơn giản hơn. Ví dụ:
CaCO3 → CaO + CO2
Trong phản ứng này, canxi cacbonat (CaCO3) bị phân hủy thành canxi oxit (CaO) và khí cacbonic (CO2).
Khám phá ngay chuyên mục “Tài liệu hóa học phổ thông” để nắm vững kiến thức từ cơ bản đến nâng cao!
Gợi Ý Bài Tập Về Tính Chất Hóa Học Của Muối
Dưới đây là một số bài tập giúp bạn nắm vững hơn về tính chất hóa học của muối:
Câu hỏi: Hãy nêu tính chất hóa học của muối khi phản ứng với axit tạo ra chất khí hoặc chất kết tủa. Viết phương trình phản ứng minh họa.
Gợi ý:
Ví dụ cho phản ứng tạo khí:
Na2CO3 + HCl → 2NaCl + CO2↑ + H2O
Ví dụ cho phản ứng tạo kết tủa:
NaCl + AgNO3 → NaNO3 + AgCl↓
Hướng Dẫn Điều Chế Muối
Muối có thể được điều chế thông qua nhiều phương pháp khác nhau, trong đó phổ biến nhất là phản ứng trung hòa giữa axit và bazo. Ví dụ:
Phản ứng trung hòa:
HCl + NaOH → NaCl + H2O

Lời kết
Trên đây là những kiến thức cơ bản về muối, từ khái niệm, phân loại cho đến tính chất hóa học của muối và phương pháp điều chế. Hy vọng rằng qua bài viết này, bạn đã có thể nắm bắt và vận dụng được các kiến thức về muối vào học tập và thực tiễn.
Có thể bạn quan tâm: