Sắt hydroxide, biểu thị bằng công thức hóa học Fe(OH)2, là một hợp chất quan trọng trong hóa học vô cơ. Nó có tính chất hấp dẫn và được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau, từ công nghiệp đến y học. Sắt(II) hydroxide xuất hiện dưới dạng kết tủa màu xanh lá cây, đóng vai trò là chất trung gian trong nhiều phản ứng hóa học. Trong bài viết này, hoahocphothong sẽ khám phá tính chất hóa học của Fe(OH)2, cách điều chế nó, các phản ứng hóa học quan trọng, và những ứng dụng thiết thực trong thực tế.
TÓM TẮT
- 1 Tính Chất Hóa Học của Fe(OH)2 (Sắt Hydroxide)
- 1.1 Tính Chất Oxi Hóa
- 1.2 Tính Axit-Bazơ
- 1.3 Tính Chất Phản Ứng với Các Chất Khác
- 1.4 Tính Chất Kết Tủa
- 1.5 Tính Khử
- 1.6 Phản Ứng với Oxy và Nước
- 1.7 Phân Tích Phản Ứng
- 1.8 Cân Bằng Phương Trình Hóa Học
- 1.9 Cách Thực Hiện Phản Ứng
- 1.10 Hiện Tượng Nhận Biết Phản Ứng
- 1.11 Ứng Dụng của Hợp Chất Sắt (III)
- 1.12 Tính Chất Vật Lý của Sắt Hydroxide
- 2 Kết Luận
Tính Chất Hóa Học của Fe(OH)2 (Sắt Hydroxide)
Sắt(II) hydroxide, với tính chất hóa học của fe(oh)2, là một hợp chất quan trọng trong hóa học vô cơ. Dưới đây là một số nét nổi bật về tính chất hóa học của bazo này:
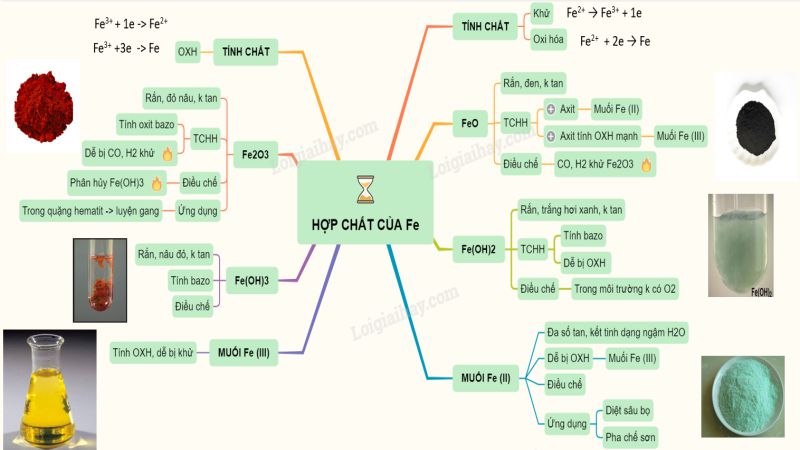
Tính Chất Oxi Hóa
Tính chất hóa học của Fe(OH)2 có thể bị oxi hóa thành sắt(III) hydroxide (Fe(OH)3) khi tiếp xúc với oxy trong không khí và nước. Phản ứng này có thể được biểu diễn bằng phương trình hóa học sau:
4Fe(OH)2+O2+2H2O→4Fe(OH)3\text{4Fe(OH)}_2 + \text{O}_2 + \text{2H}_2\text{O} \rightarrow \text{4Fe(OH)}_3 4Fe(OH)2+O2+2H2O→4Fe(OH)3
Trong quá trình này, sắt trong Fe(OH)2 tăng số oxi hóa từ +2 lên +3, trong khi oxy giảm số oxi hóa từ 0 xuống -2.
Tính Axit-Bazơ
Fe(OH)2 có tính kiềm và có khả năng phản ứng với axit để tạo thành muối và nước. Khi phản ứng với axit clohidric (HCl), nó sẽ tạo ra sắt(II) chloride và nước:
Fe(OH)2+2HCl→FeCl2+2H2O\text{Fe(OH)}_2 + 2\text{HCl} \rightarrow \text{FeCl}_2 + 2\text{H}_2\text{O} Fe(OH)2+2HCl→FeCl2+2H2O
Tính Chất Phản Ứng với Các Chất Khác
Fe(OH)2 có thể phản ứng với các chất khác như muối và bazơ. Khi tương tác với các ion kim loại khác, nó có thể tạo ra các hợp chất phức tạp hoặc kết tủa.
Tính Chất Kết Tủa
Fe(OH)2 thường xuất hiện dưới dạng kết tủa khi sắt(II) ion phản ứng với hydroxide ion trong dung dịch. Kết tủa này có màu xanh lá cây nhạt và không tan trong nước, nhưng có thể tan trong axit.
Tính Khử
Fe(OH)2 có khả năng làm chất khử trong một số phản ứng hóa học. Nó có thể nhường electron cho các chất khác, tham gia vào các quá trình oxi hóa-khử.
Tính chất hóa học của sắt(II) hydroxide (Fe(OH)2) không chỉ làm cho nó trở thành một hợp chất thú vị trong hóa học, mà còn mở ra nhiều ứng dụng trong công nghiệp, xử lý nước, và các lĩnh vực nghiên cứu khoa học khác. Việc hiểu rõ tính chất hóa học của hợp chất này sẽ giúp trong việc phát triển các ứng dụng thực tiễn và cải thiện quy trình xử lý hóa học.
Phản Ứng với Oxy và Nước
Phản ứng hóa học quan trọng nhất liên quan đến sắt hydroxide là phản ứng oxi hóa để tạo ra sắt(III) hydroxide (Fe(OH)3). Phương trình phản ứng có thể được mô tả như sau:
4Fe(OH)2+O2+2H2O→4Fe(OH)3\text{4Fe(OH)}_2 + \text{O}_2 + \text{2H}_2\text{O} \rightarrow \text{4Fe(OH)}_3 4Fe(OH)2+O2+2H2O→4Fe(OH)3
Phân Tích Phản Ứng
Sắt(II) Hydroxide (Fe(OH)2): Là chất tham gia chính, sắt ở trạng thái oxi hóa +2 sẽ bị oxi hóa thành +3.
Oxy (O2): Tham gia vào quá trình oxi hóa, đóng vai trò là chất nhận electron.
Nước (H2O): Có thể đóng vai trò như chất khử, hỗ trợ trong quá trình tạo ra hydroxide.
Cân Bằng Phương Trình Hóa Học
Để đảm bảo phương trình hóa học cân bằng, ta cần đảm bảo số lượng nguyên tử của mỗi nguyên tố trên cả hai phía của phương trình bằng nhau. Sau khi cân bằng, phương trình phản ứng trở thành:
4Fe(OH)2+O2+2H2O→4Fe(OH)3\text{4Fe(OH)}_2 + \text{O}_2 + \text{2H}_2\text{O} \rightarrow \text{4Fe(OH)}_3 4Fe(OH)2+O2+2H2O→4Fe(OH)3
Cách Thực Hiện Phản Ứng
Để tiến hành phản ứng chuyển đổi Fe(OH)2 thành Fe(OH)3, bạn có thể thực hiện theo các bước sau:
- Chuẩn Bị Dung Dịch Fe(OH)2: Hòa tan một lượng Fe(OH)2 vào nước để tạo dung dịch.
- Cung Cấp Oxy: Đưa không khí chứa oxy vào dung dịch bằng cách thổi khí hoặc sử dụng bình oxy.
- Quan Sát Phản Ứng: Theo dõi màu sắc của dung dịch. Bạn sẽ thấy sự chuyển màu từ xanh lá cây của Fe(OH)2 sang nâu đỏ của Fe(OH)3.
Hiện Tượng Nhận Biết Phản Ứng
Khi thực hiện phản ứng, bạn sẽ thấy một sự thay đổi màu sắc rõ rệt. Fe(OH)2 ban đầu có màu xanh lá cây, nhưng sau khi phản ứng với oxy và nước, nó sẽ chuyển sang màu nâu đỏ của Fe(OH)3. Đây là một ví dụ điển hình cho phản ứng oxi hóa.
Khám phá ngay chuyên mục “Tài liệu Hóa Học Phổ Thông” để nắm vững kiến thức từ cơ bản đến nâng cao!
Ứng Dụng của Hợp Chất Sắt (III)
Hợp chất sắt(III) không chỉ là sản phẩm của phản ứng hóa học giữa Fe(OH)2 và oxy, mà còn có nhiều ứng dụng thực tiễn khác nhau:
Sắt (III) Hydroxide (Fe(OH)3): Được sử dụng trong xử lý nước, giúp loại bỏ các chất hữu cơ và ion kim loại nặng.
Sắt (III) Sulfate (Fe2(SO4)3): Sử dụng trong sản xuất mực in và thuốc nhuộm.
Sắt (III) Nitrate (Fe(NO3)3): Được dùng trong quá trình tẩy trắng giấy và sản xuất thuốc nhuộm.
Sắt (III) Acetate (Fe(C2H3O2)3): Ứng dụng trong sản xuất mực in, nhuộm vải, và chất xử lý nước.
Tính Chất Vật Lý của Sắt Hydroxide
Sắt hydroxide là một hợp chất rắn không tan trong nước, với kết cấu tinh thể dạng mịn. Dưới đây là một số tính chất vật lý tiêu biểu của Fe(OH)2:
Màu sắc: Sắt(II) hydroxide có màu xanh lá cây nhạt.
Tính chất hòa tan: Hợp chất này không hòa tan trong nước, nhưng có thể hòa tan trong axit tạo thành muối sắt.
Kết tủa: Khi sắt(II) ion phản ứng với hydroxide ion, một kết tủa Fe(OH)2 sẽ hình thành.
Kết Luận
Sắt hydroxide (Fe(OH)2) là một hợp chất thú vị với nhiều tính chất hóa học của fe(oh)2 và ứng dụng thiết thực. Từ phản ứng với oxy và nước, chúng ta có thể sản xuất ra sắt(III) hydroxide (Fe(OH)3), mở ra nhiều cơ hội cho nghiên cứu và ứng dụng trong các lĩnh vực công nghiệp và môi trường. Việc tìm hiểu sâu về các hợp chất này không chỉ giúp nâng cao kiến thức hóa học mà còn đóng góp vào sự phát triển bền vững của xã hội.
Có thể bạn quan tâm:











